Kemisk reaktion mellem phenol og bromvand?
reaktanter:
* phenol (C6H5OH): En aromatisk forbindelse med en hydroxylgruppe (-OH) fastgjort til benzenringen.
* bromvand (Br2 (aq)): En opløsning af brom (BR2) i vand.
Produkter:
* 2,4,6-tribromophenol (C6H2BR3OH): Et hvidt fast stof dannet ved substitution af tre bromatomer på phenolringen.
* Hydrogenbromid (HBR): En farveløs gas, normalt opløst i vand til dannelse af hydrobrominsyre.
Reaktionsmekanisme:
1. Elektrofilt angreb: Brom (BR2) er en svag elektrofil. I nærvær af vand bliver det imidlertid polariseret, hvilket gør et bromatom mere elektrofil. Denne elektrofil angriber den elektronrige benzenring af phenol.
2. Dannelse af en carbocation: Angrebet fører til dannelsen af et positivt ladet mellemprodukt kaldet en carbocation.
3. tab af en proton: Karbokationen er ustabil og mister en proton (H+) fra kulstof ved siden af bromineringsstedet. Denne gendanner aromaticiteten over for ringen.
4. Yderligere bromering: Bromatomet på phenolringen aktiverer ortho- og para -positionerne for yderligere elektrofilt angreb fra brom. Som et resultat fortsætter reaktionen, hvilket fører til dannelsen af 2,4,6-tribromophenol.
Observationer:
* farveændring: Det gulbrune bromvand afholoriserer hurtigt, når reaktionen fortsætter.
* hvidt bundfald: Der dannes et hvidt bundfald på 2,4,6-tribromophenol.
Reaktionsligning:
C6H5OH + 3BR2 (aq) → C6H2BR3OH + 3HBR
Vigtige punkter:
* Reaktionen er stærkt påvirket af tilstedeværelsen af hydroxylgruppen på phenolringen. Den elektron-donerende virkning af hydroxylgruppen gør benzenringen mere elektronrig og modtagelig for elektrofil angreb.
* Denne reaktion bruges også som en test for tilstedeværelsen af phenol. Hvis bromvand affugler hurtigt, og der dannes et hvidt bundfald, bekræfter det tilstedeværelsen af phenol.
* Reaktionen udføres ofte i nærvær af en katalysator som jern (III) bromid (februar). Katalysatoren hjælper med at polarisere brommolekylet og lette det elektrofile angreb.
Fortæl mig, hvis du har yderligere spørgsmål!
 Varme artikler
Varme artikler
-
 Avanceret mikroskopi afslører usædvanlig DNA-strukturAdam Backer, en optisk videnskabsmand ved Sandia National Laboratories, hjulpet med at udvikle en avanceret mikroskopiteknik, der afslørede stærkt hældende basepar i en strakt form af DNA. Kredit:Rand
Avanceret mikroskopi afslører usædvanlig DNA-strukturAdam Backer, en optisk videnskabsmand ved Sandia National Laboratories, hjulpet med at udvikle en avanceret mikroskopiteknik, der afslørede stærkt hældende basepar i en strakt form af DNA. Kredit:Rand -
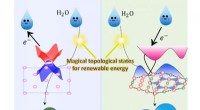 Fremskynde brintproduktionen ved hjælp af de magiske topologiske overfladetilstandeTopologiske ikke-trivielle overfladetilstande kan acceptere eller donere elektroner under vandelektrolyseprocessen. Kredit:MPI CPfS Brintøkonomien anses for at være en af de bedste muligheder fo
Fremskynde brintproduktionen ved hjælp af de magiske topologiske overfladetilstandeTopologiske ikke-trivielle overfladetilstande kan acceptere eller donere elektroner under vandelektrolyseprocessen. Kredit:MPI CPfS Brintøkonomien anses for at være en af de bedste muligheder fo -
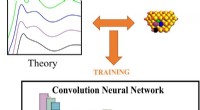 Maskinlæringsanalyse af røntgendata udvælger vigtige katalytiske egenskaberDette skema viser, hvordan spektre afledt af teoriberegninger ved hjælp af kendte strukturer (øverst) kan bruges til at træne et neuralt netværk (i midten), som så kan bruge sin samlede viden til at o
Maskinlæringsanalyse af røntgendata udvælger vigtige katalytiske egenskaberDette skema viser, hvordan spektre afledt af teoriberegninger ved hjælp af kendte strukturer (øverst) kan bruges til at træne et neuralt netværk (i midten), som så kan bruge sin samlede viden til at o -
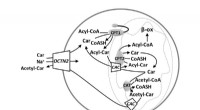 OCTN:En transportør med relevans for human patofysiologi, opdagelse og diagnostik af lægemidlerOCTN:En lille transportfamilie med stor relevans for menneskelig patofysiologi, Drug Discovery and Diagnostics Credit:Cesare Indiveri I februar 2019 -udgaven af SLAS Discovery , en gennemgang af
OCTN:En transportør med relevans for human patofysiologi, opdagelse og diagnostik af lægemidlerOCTN:En lille transportfamilie med stor relevans for menneskelig patofysiologi, Drug Discovery and Diagnostics Credit:Cesare Indiveri I februar 2019 -udgaven af SLAS Discovery , en gennemgang af
- Nye støvkilder fra et krympende Saltonhav har negative økologiske og sundhedsmæssige konsekvenser
- Ny form for lys:Nyligt observeret optisk tilstand kunne muliggøre kvanteberegning med fotoner
- Kan defekter gøre inerte materialer til nyttige, aktive?
- 21 døde, da voldsom nedbør rammer det centrale Kina
- Colombias fredsaftale bringer ny trussel mod landets regnskov
- Ny forskning integrerer borophen og grafen i 2-D heterostrukturer


