Hvilke molekyler var ikke -polære, fordi alle bindinger ikke -polære?
Forståelse af polaritet
* polære obligationer: Forekommer, når to atomer med forskellig elektronegativitet (evnen til at tiltrække elektroner) deler elektroner ulige. Dette skaber en let positiv ladning på det ene atom og en let negativ ladning på den anden.
* ikke -polære bindinger: Forekommer, når to atomer med lignende elektronegativitet deler elektroner lige. Der er ingen adskillelse af opladning.
* ikke -polære molekyler: Et molekyle er ikke -polært, hvis alle dens bindinger er ikke -polære og Molekylets form er symmetrisk. Dette betyder, at de polære obligationer annullerer hinanden.
Eksempler på molekyler med alle ikke -polære bindinger
* H₂ (brintgas): Begge hydrogenatomer har den samme elektronegativitet, så bindingen er ikke -polær. Molekylet er også lineært og symmetrisk.
* cl₂ (klorgas): Begge kloratomer har den samme elektronegativitet, hvilket resulterer i en ikke -polær binding. Molekylet er lineært og symmetrisk.
* o₂ (iltgas): Begge iltatomer har den samme elektronegativitet, hvilket skaber en ikke -polær binding. Molekylet er lineært og symmetrisk.
* n₂ (nitrogengas): Begge nitrogenatomer har den samme elektronegativitet, hvilket resulterer i en ikke -polær binding. Molekylet er lineært og symmetrisk.
* co₂ (kuldioxid): Mens carbon og ilt har forskellige elektronegativiteter, er de to C =O -bindinger polære. Imidlertid betyder den lineære form af co₂, at polariteterne annullerer hinanden, hvilket gør molekylet ikke -polært generelt.
Vigtig note: Bare fordi et molekyle har alle ikke -polære bindinger, betyder det ikke automatisk, at det er ikke -polært. Molekylets form spiller også en afgørende rolle. For eksempel har vand (H₂O) polære bindinger, men er et polært molekyle på grund af dets bøjede form.
 Varme artikler
Varme artikler
-
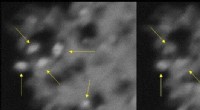 Usædvanlige nanopartikler kan gavne søgen efter at bygge en kvantecomputerPilene peger på, at titandioxid nanokrystaller lyser og blinker (venstre) og derefter falmer (højre). Kredit:Tewodros Asefa og Eliska Mikmekova Forestil dig små krystaller, der blinker som ildflue
Usædvanlige nanopartikler kan gavne søgen efter at bygge en kvantecomputerPilene peger på, at titandioxid nanokrystaller lyser og blinker (venstre) og derefter falmer (højre). Kredit:Tewodros Asefa og Eliska Mikmekova Forestil dig små krystaller, der blinker som ildflue -
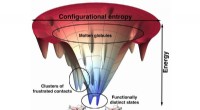 Atomopløsningsproteinmodeller afslører nye detaljer om proteinbindingAtomskalamodeller af Rice University-forskere baseret på dem, der bruges til at forudsige, hvordan proteiner folder, viser en stærk sammenhæng mellem minimalt frustrerede bindingssteder og lægemiddels
Atomopløsningsproteinmodeller afslører nye detaljer om proteinbindingAtomskalamodeller af Rice University-forskere baseret på dem, der bruges til at forudsige, hvordan proteiner folder, viser en stærk sammenhæng mellem minimalt frustrerede bindingssteder og lægemiddels -
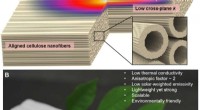 Dette er nanowood, en opfindelse, der kunne reducere menneskehedens CO2-fodaftrykFuldstændig afledt af naturligt træ, nanowood med hierarkisk justerede cellulose nanofibriller kan bruges som en anisotrop super termisk isolator. (A) Skema af de termisk isolerende egenskaber af nano
Dette er nanowood, en opfindelse, der kunne reducere menneskehedens CO2-fodaftrykFuldstændig afledt af naturligt træ, nanowood med hierarkisk justerede cellulose nanofibriller kan bruges som en anisotrop super termisk isolator. (A) Skema af de termisk isolerende egenskaber af nano -
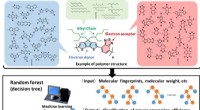 AI-software hjælper med design af nyt materiale til solcellerFig. 1. Udforskning af nye polymerer til polymersolceller ved hjælp af materialeinformatik. (Øvre) Eksempel på en polymerstruktur bestående af elektrondonor, elektronacceptor, og alkylkæder. (Mellem)
AI-software hjælper med design af nyt materiale til solcellerFig. 1. Udforskning af nye polymerer til polymersolceller ved hjælp af materialeinformatik. (Øvre) Eksempel på en polymerstruktur bestående af elektrondonor, elektronacceptor, og alkylkæder. (Mellem)


