Er normalitet og molaritet for natriumthiosulfat det samme?
* Molaritet Repræsenterer antallet af mol opløst stof pr. Liter opløsning.
* Normalitet Repræsenterer antallet af ækvivalenter af opløst stof pr. Liter opløsning.
Natriumthiosulfat (Na₂s₂o₃) har to ækvivalenter pr. Mol på grund af tilstedeværelsen af to svovlatomer, der kan gennemgå redoxreaktioner.
Derfor er normaliteten af en natriumthiosulfatopløsning dobbelt så stor som molaritet.
Eksempel:
En 0,1 m opløsning af natriumthiosulfat vil have en normalitet på 0,2 N.
Vigtig note: Normalitet er ikke en universel enhed og afhænger af den specifikke reaktion, der overvejes. I nogle reaktioner kan natriumthiosulfat have et andet antal ækvivalenter. Det er altid bedst at specificere den specifikke reaktion, når man bruger normalitet.
Sidste artikelBeregn molariteten af en 10 procent vandig opløsning HCl?
Næste artikelHvad er formlen for aluminium og fosfor?
 Varme artikler
Varme artikler
-
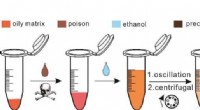 Ethanol-ekstraktion SERS-strategi giver meget følsom påvisning af giftstoffer i olieagtig matrixSkematisk diagram af SERS-detektion baseret på ethanolekstraktion. Kredit:WANG Yongtao Forskere fra det kinesiske videnskabsakademi (CAS) udviklede for nylig en ethanol-ekstraktionsoverfladeforstæ
Ethanol-ekstraktion SERS-strategi giver meget følsom påvisning af giftstoffer i olieagtig matrixSkematisk diagram af SERS-detektion baseret på ethanolekstraktion. Kredit:WANG Yongtao Forskere fra det kinesiske videnskabsakademi (CAS) udviklede for nylig en ethanol-ekstraktionsoverfladeforstæ -
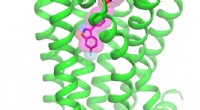 Molekylære hemmeligheder afsløret:Antipsykotikum forankret i sin receptorBredt ordineret antipsykotisk lægemiddel risperidon (lilla) er vist i interaktion med dets primære menneskelige hjernemål, D2 dopaminreceptoren (grøn). Opdagelsen af denne molekylære struktur lover
Molekylære hemmeligheder afsløret:Antipsykotikum forankret i sin receptorBredt ordineret antipsykotisk lægemiddel risperidon (lilla) er vist i interaktion med dets primære menneskelige hjernemål, D2 dopaminreceptoren (grøn). Opdagelsen af denne molekylære struktur lover -
 Ny metode afbryder trin i produktionen af smarte og funktionelle tekstilerEt polymert materiale med elektrisk ledende egenskaber er 3-D-trykt direkte på tekstilet (afhandlingens forsidefoto). Kredit:Borås Universitet Dagens ressourceintensive produktionsprocesser til ud
Ny metode afbryder trin i produktionen af smarte og funktionelle tekstilerEt polymert materiale med elektrisk ledende egenskaber er 3-D-trykt direkte på tekstilet (afhandlingens forsidefoto). Kredit:Borås Universitet Dagens ressourceintensive produktionsprocesser til ud -
 Rødt lys til stress:En farveskiftende organisk krystalKredit:Institut for Industrividenskab, Universitetet i Tokyo Forskere ved Institut for Industrividenskab, del af University of Tokyo, og Yokohama City University har introduceret nye farveskiftend
Rødt lys til stress:En farveskiftende organisk krystalKredit:Institut for Industrividenskab, Universitetet i Tokyo Forskere ved Institut for Industrividenskab, del af University of Tokyo, og Yokohama City University har introduceret nye farveskiftend
- Forskere identificerer, hvordan dissektionen af arktiske landskaber ændrer sig med accelererende …
- Hvilken elektrisk energi konverterede inde i en brødrister?
- 'Søer' under Mars' sydpol:Et mudret billede?
- Hvor mange AU er alpha centauri fra jorden?
- Små bobler dannet af store organiske molekyler?
- Hvorfor ville det være mere skadeligt for en mutation at forekomme i reproduktionscelle end kropsce…


