Beregn molariteten af en 10 procent vandig opløsning HCl?
1. Forstå koncentrationsenheden:
* 10% (w/w): Dette betyder, at der er 10 gram HCI for hver 100 gram opløsning.
2. Antag en løsningsmasse:
* For at gøre beregningen lettere, lad os antage, at vi har 100 gram opløsning. Dette betyder, at vi har 10 gram HCL.
3. Konverter masse af HCL til mol:
* molmasse HCL: 1,01 g/mol (H) + 35,45 g/mol (Cl) =36,46 g/mol
* mol HCL: (10 g HCI) / (36,46 g / mol) =0,274 mol HCI
4. Beregn mængden af løsningen:
* densitet på 10% HCI -opløsning: Cirka 1,05 g/ml (dette kan variere lidt afhængigt af den nøjagtige koncentration)
* Løsningsvolumen: (100 g opløsning) / (1,05 g / ml) =95,2 ml =0,0952 L
5. Beregn molaritet:
* molaritet (m) =mol opløst / liter opløsning
* Molaritet: (0,274 mol HCl) / (0,0952 L) = 2,88 m
Derfor er en vandig opløsning på 10% (w/w) ca. 2,88 m.
Vigtig note: Løsningen af opløsningen er en tilnærmelse. For meget nøjagtige molaritetsberegninger skal du kende den nøjagtige densitet af den specifikke HCL -løsning, du arbejder med.
 Varme artikler
Varme artikler
-
 En forenklet metode til at kategorisere olivenolieLourdes Arce og Natividad Jurado, efterforskere fra Universidad de Cordoba. Kredit:University of Cordoba Klassificering af olivenolie er i øjeblikket meget dyr og langsom. For at kategorisere olie
En forenklet metode til at kategorisere olivenolieLourdes Arce og Natividad Jurado, efterforskere fra Universidad de Cordoba. Kredit:University of Cordoba Klassificering af olivenolie er i øjeblikket meget dyr og langsom. For at kategorisere olie -
 Forskere skaber brintbrændstof fra havvandEn prototype -enhed brugte solenergi til at skabe brintbrændstof fra havvand. Kredit:H. Dai, Yun Kuang, Michael Kenney Stanford -forskere har udtænkt en måde at generere brintbrændstof ved hjælp a
Forskere skaber brintbrændstof fra havvandEn prototype -enhed brugte solenergi til at skabe brintbrændstof fra havvand. Kredit:H. Dai, Yun Kuang, Michael Kenney Stanford -forskere har udtænkt en måde at generere brintbrændstof ved hjælp a -
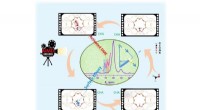 Undersøgelse afslører dannelsesmekanismen for den første carbon-carbon-binding i MTO-processenAfsløring af hele de første C-C-bindingsdannelsesprocesser i MTO-reaktion:baseret på in situ NMR spektroskopiske beviser og avanceret ab initio molekylær dynamik (AIMD) teoretisk beregningsmetode. Kre
Undersøgelse afslører dannelsesmekanismen for den første carbon-carbon-binding i MTO-processenAfsløring af hele de første C-C-bindingsdannelsesprocesser i MTO-reaktion:baseret på in situ NMR spektroskopiske beviser og avanceret ab initio molekylær dynamik (AIMD) teoretisk beregningsmetode. Kre -
 Forskere opdager en ny tilgang til stabilisering af katodematerialerBrookhaven -kemiker Ruoqian Lin, første forfatter til undersøgelsen. Kredit:Brookhaven National Laboratory Et team af forskere ledet af kemikere ved US Department of Energys (DOE) Brookhaven Natio
Forskere opdager en ny tilgang til stabilisering af katodematerialerBrookhaven -kemiker Ruoqian Lin, første forfatter til undersøgelsen. Kredit:Brookhaven National Laboratory Et team af forskere ledet af kemikere ved US Department of Energys (DOE) Brookhaven Natio
- Hvordan en slank, slangelignende robot kunne give læger nye måder at redde liv på
- Hvilken type pladegrænse ville du finde, hvor havbunden spreder sig?
- Solformørkelse en chance for at studere livets modstandsdygtighed
- Hvilken rigelig kemisk forbindelse på Pluto?
- Ny teknik til molekylær billeddannelse kaster komplekse koordinationsmolekyler i et nyt lys
- Nuklear scanningsteknik vil bringe fordele til mineindustrien


