Hvordan danner ammoniumion et uopløseligt salt?
Her er hvorfor:
* ammoniumion er en lille, meget ladet kation: Dette gør det stærkt tiltrukket af anioner i opløsning, hvilket fører til stærke ioniske bindinger.
* ioniske forbindelser med ammonium er generelt opløselige: Den stærke tiltrækning mellem ammonium og anioner overvinder kræfterne, der holder ionerne sammen i krystalgitteret, hvilket gør salterne let opløses i vand.
Undtagelser:
Mens de fleste ammoniumsalte er opløselige, findes der nogle få bemærkelsesværdige undtagelser:
* ammonium hexachloroplatinat (iv) [(nh₄) ₂ [ptcl₆]]: Dette salt er gult, krystallinsk og relativt uopløseligt i vand. Det blev historisk anvendt i analysen af kaliumioner.
* ammonium tetraphenylborat [(nh₄) [b (c₆h₅) ₄]]: Denne forbindelse er også relativt uopløselig i vand. Det bruges i analytisk kemi til at udfælde kalium og andre store kationer.
Nøglepunkt:
Opløseligheden af ammoniumsalte er generelt høj, hvilket gør dem let opløselige i vand. De få undtagelser er hovedsageligt specifikke, komplekse salte, der bruges til analytiske formål.
Sidste artikelHvor mange ydre skalelektroner har svovl?
Næste artikelHvor mange atomer i jernoxid Fe2O3?
 Varme artikler
Varme artikler
-
 Blåt farvestof fra rødbeder:Kemikere udtænker en ny pigmentmulighedGennem kemiens vidundere, molekyler kan omarrangeres til fuldstændig at transformere farve. Kredit:Erick Leite Bastos, CC BY-SA Hvad er din yndlingsfarve? Hvis du svarede blåt, du er i godt selska
Blåt farvestof fra rødbeder:Kemikere udtænker en ny pigmentmulighedGennem kemiens vidundere, molekyler kan omarrangeres til fuldstændig at transformere farve. Kredit:Erick Leite Bastos, CC BY-SA Hvad er din yndlingsfarve? Hvis du svarede blåt, du er i godt selska -
 En intelligent, formformende, selvhelbredende materiale til integreret kunstig muskel og nervevævForskere udvikler et formformende materiale med en hidtil uset multifunktionalitet til blød robotik og bærbar elektronik. Kredit:Soft Machines Lab, Carnegie Mellon University Fremskridt inden for
En intelligent, formformende, selvhelbredende materiale til integreret kunstig muskel og nervevævForskere udvikler et formformende materiale med en hidtil uset multifunktionalitet til blød robotik og bærbar elektronik. Kredit:Soft Machines Lab, Carnegie Mellon University Fremskridt inden for -
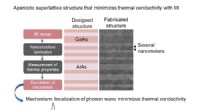 Minimering af termisk ledningsevne af krystallinsk materiale med optimal nanostrukturDen optimale nanostruktur designet med MI (aperiodisk supergitterstruktur) blev faktisk fremstillet, og den optimale ydeevne blev verificeret ved at vurdere dens varmeledningsevne. Figur:Den faktiske
Minimering af termisk ledningsevne af krystallinsk materiale med optimal nanostrukturDen optimale nanostruktur designet med MI (aperiodisk supergitterstruktur) blev faktisk fremstillet, og den optimale ydeevne blev verificeret ved at vurdere dens varmeledningsevne. Figur:Den faktiske -
 Ny proteinbilleddannelsesmetode baner vej for næste generations biomaterialer og vævsanalyseKredit:Unsplash/CC0 Public Domain Forskere har etableret en ny metode til billedproteiner, der kan føre til nye opdagelser i sygdomme gennem biologisk vævs- og celleanalyse og udvikling af nye bio
Ny proteinbilleddannelsesmetode baner vej for næste generations biomaterialer og vævsanalyseKredit:Unsplash/CC0 Public Domain Forskere har etableret en ny metode til billedproteiner, der kan føre til nye opdagelser i sygdomme gennem biologisk vævs- og celleanalyse og udvikling af nye bio
- Hvilken type produkt dannes på reaktion En alkohol med Na metal?
- Genetisk plan for ananasmynter:En omfattende genomsamling
- Kulstofopsamling kan være en økonomisk mulighed for amerikanske biobrændstoffer
- Hvordan de forkerte gener undertrykkes
- Gode nyheder? Grønland smelter, men mindre hurtigt end forudsagt
- Hvordan du kan hjælpe videnskabsmænd med at studere atmosfæren på Jupiter


