Hvad er Lewis -struktur for brintsulfid?
1. Bestem det samlede antal valenselektroner:
* Hydrogen (H) har 1 valenselektron hver, og der er 2 hydrogenatomer:1 x 2 =2 elektroner
* Svovl (er) har 6 valenselektroner.
Samlede valenselektroner =2 + 6 =8 elektroner
2. Bestem det centrale atom:
* Svovl er det centrale atom, fordi det er mindre elektronegativt end brint.
3. Tilslut atomerne med enkeltbindinger:
* Placer svovlatomet i midten, og tilslut hvert hydrogenatom til det med en enkelt binding (en linje). Dette bruger 2 af de 8 valenselektroner.
4. Distribuer de resterende elektroner omkring atomerne:
* Svovl har brug for 6 elektroner for at afslutte sine oktet (8 elektroner).
* Tilsæt 4 ensomme par (2 par) elektroner omkring svovlatomet.
5. Kontroller Octets:
* Hydrogen har kun brug for 2 elektroner for at afslutte dens duet (2 elektroner). Hvert hydrogenatom har 1 binding, der opfylder dette krav.
* Svovl har 2 bindinger (4 elektroner) og 4 ensomme par (8 elektroner), der afslutter sin oktet.
Lewis -strukturen af H₂s:
`` `
H
|
S
|
H
`` `
Hvor linjerne repræsenterer enkeltbindinger, og prikkerne repræsenterer ensomme par elektroner.
Sidste artikelHvilken ende af vandmolekyle fungerer negative?
Næste artikelHvad er den kemiske formel for jern2 -phosphat?
 Varme artikler
Varme artikler
-
 Nitrogen kommer i den hurtige bane til kemisk synteseRice University kemikere har opdaget en et-trins metode til at omdanne silicium-baseret silylenol ether til nitrogen-bærende alfa-aminoketoner, værdifulde byggesten i kemisk design. Kredit:Zhe Zhou/Ri
Nitrogen kommer i den hurtige bane til kemisk synteseRice University kemikere har opdaget en et-trins metode til at omdanne silicium-baseret silylenol ether til nitrogen-bærende alfa-aminoketoner, værdifulde byggesten i kemisk design. Kredit:Zhe Zhou/Ri -
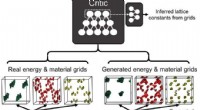 Omvendt design af porøse materialer ved hjælp af kunstige neurale netværkOverordnede skemaer af ZeoGAN. Energi (grøn) refererer i dette tilfælde til potentiel metanenergi, og materialegitter angiver silicium (rød) og oxygen (gule) atomer. Kredit:Science Advances, doi:10.11
Omvendt design af porøse materialer ved hjælp af kunstige neurale netværkOverordnede skemaer af ZeoGAN. Energi (grøn) refererer i dette tilfælde til potentiel metanenergi, og materialegitter angiver silicium (rød) og oxygen (gule) atomer. Kredit:Science Advances, doi:10.11 -
 Biofysikere målretter mod mekanisme, der gør Zika -virus så farligtKredit: Naturens kemiske biologi (2021). DOI:10.1038/s41589-021-00829-z En ny undersøgelse foretaget af biofysikere fra University of Alberta har afsløret, hvordan en sjælden struktur dannes i RN
Biofysikere målretter mod mekanisme, der gør Zika -virus så farligtKredit: Naturens kemiske biologi (2021). DOI:10.1038/s41589-021-00829-z En ny undersøgelse foretaget af biofysikere fra University of Alberta har afsløret, hvordan en sjælden struktur dannes i RN -
 Fødevareforskere skaber sunde probiotiske drik fra sojapulpLektor Shao-Quan Liu og ph.d.-studerende Weng-Chan Vong fra NUS Food Science and Technology Program har udtænkt en unik cocktail af enzymer, probiotika og gær til at producere en okara-drik rig på tar
Fødevareforskere skaber sunde probiotiske drik fra sojapulpLektor Shao-Quan Liu og ph.d.-studerende Weng-Chan Vong fra NUS Food Science and Technology Program har udtænkt en unik cocktail af enzymer, probiotika og gær til at producere en okara-drik rig på tar
- Meteoritter giver spor til solsystemernes oprindelse
- Hvad hvis vi levede på månen?
- Forskere finder uventet elektrisk strøm, der kan stabilisere fusionsreaktioner
- Vil du se Disneyland uden at tage dertil? Prøv Street View
- Hvordan er videnskabsmand i stand til at studere sammensætningen og størrelsen på indvendige lag …
- Forskere opdager den uventede atomstruktur af kulde og mentolsensor TRPM8


