Forskere opdager den uventede atomstruktur af kulde og mentolsensor TRPM8
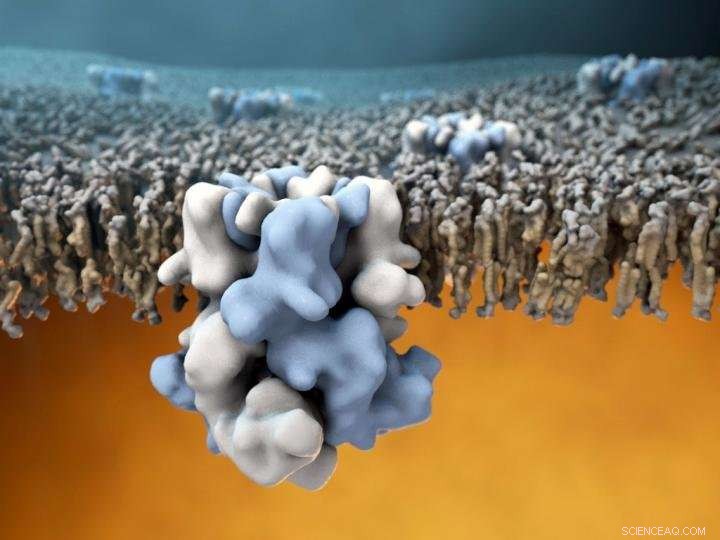
TRPM8 -ionkanalen (blå og hvid i midten) er indlejret i den ydre membran af celler, og er i stand til at fornemme kolde temperaturer på ydersiden (den øverste halvdel af billedet), og formidle disse oplysninger til det varme mobilinteriør (nederste halvdel af billedet). Kredit:Gabe Lander og Graham Johnson
Et team af forskere fra The Scripps Research Institute (TSRI) og Duke University har foretaget den første bestemmelse af atomstrukturen af Transient Receptor Potential Melastatin 8 (TRPM8), en molekylær sensor i nerveender, der registrerer kolde temperaturer samt menthol og andre kemikalier, der fremkalder kolde fornemmelser.
Dette fund bør øge forskernes igangværende indsats for at målrette TRPM8 terapeutisk. Lægemiddelforbindelser, der interagerer med koldføleren-som mentholholdige salver allerede gør-kan muligvis behandle nogle former for kronisk smerte og betændelse, migræne og endda kræft.
"At kende atomstrukturen i TRPM8, og hvordan den reagerer på kulde, menthol og andre stimuli skal hjælpe med at designe potente og selektive nye lægemidler rettet mod denne sensor, "sagde studieleder Gabriel C. Lander, Ph.d., lektor ved TSRI, der ledede undersøgelsen sammen med Dr. Seok-Yong Lee ved Duke University School of Medicine.
Opdagelsen, offentliggjort den 7. december, 2017 i journalen Videnskab , er også en betydelig teknisk bedrift. Lige siden det koldfølende protein først blev identificeret i 2002, hold rundt om i verden har forsøgt, men ikke formået at bestemme atomstrukturen i TRPM8 ved hjælp af røntgenkrystallografi, traditionelt go-to-metoden til løsning af proteiner med store proteiner. At opnå en struktur med høj opløsning af TRPM8 har udgjort en stor udfordring for strukturbiologer til dels på grund af kanalens ustabilitet, når den isoleres fra dens oprindelige miljø i cellemembranen. Uden membranstøtte, TRPM8 har en tendens til at miste sin strukturelle integritet, gør målet meget svært at studere. TRPM8 -sensorstrukturen er også relativt kompleks, består af fire identiske kopier af proteinet kodet af TRPM8 -genet.
Til dette projekt, Lander og medforfatter forfatter Mengyu Wu, en kandidatstuderende i sit laboratorium, valgte i stedet at bruge kryo-elektronmikroskopi (kryo-EM), en strukturbestemmelsesmetode, der i stigende grad foretrækkes til vanskelige strukturelle undersøgelser. Lee og hans team begyndte med at screene TRPM8 -proteiner fra mere end et dusin forskellige dyrearter, herunder mennesker, mus, og fugle, at finde en, der sandsynligvis ville være "bedst opført" til en cryo-EM undersøgelse. De slog sig ned på TRPM8 -proteinet fra en fugl kaldet fluesnapperen med halsbånd.
"Alle beviser peger på, at fluefangeren TRPM8 fungerer på samme måde som pattedyrs TRPM8'er, så vi er overbeviste om, at vores strukturelle analyse vil oversætte direkte til den menneskelige form af denne sensor, "Sagde Lander.
Forskerne stod over for mange forhindringer på grund af den iboende ustabilitet af TRPM8 uden for dens oprindelige membranmiljø. "Selv inden for en enkelt dag efter afsendelse af prøverne fra Duke til TSRI, proteinkomplekset ville begynde at falde fra hinanden, "sagde Wu." Lee -laboratoriet tilføjede strategisk et par stabiliserende mutationer til proteinet, så det ville være mindre tilbøjeligt til nedbrydning. "Ying Yin, en kandidatstuderende i Lee -laboratoriet, gik også tilbage og omhyggeligt screenet gennem flere rensningsbetingelser for at give prøven yderligere stabilitet.
Proteinet opførte sig også anderledes end de fleste af de prøver, Lander -laboratoriet typisk arbejder på til elektronmikroskopi, og det tog forskerne over et år at identificere de rigtige betingelser for at forestille sig dette udfordrende biomolekyle.
"Vi var nødt til at smide regelbogen ud og gentænke den sædvanlige tilgang til løsning af denne form for struktur, "sagde Lander.
Gennem disse tilpasninger, forskerne var i stand til at få det første strukturelle glimt af TRPM8 med en samlet opløsning på omkring 4 Ångstrøm (0,4 milliarder af en meter). Den resulterende atommodel indeholdt også nogle overraskelser. "Andre grupper har hypotetiseret om strukturen af TRPM8, og hvordan den interagerer med bindende partnere som menthol, men hvad vi fandt ud af var, at stort set alle disse uddannede gæt var temmelig langt væk, "Sagde Lander. Især bindelommen til menthol viste sig at være et uventet sted, forskellig fra ligandbindingsstedet i andre TRP -sensorer.
"En ting, denne struktur fortæller os, er, at TRP -sensorer ikke alle fungerer på samme måde, og derfor forventer jeg, at vi vil opdage mange nye sensormekanismer, når vi studerer flere af disse TRP -strukturer, "Sagde Lander.
TRPM8 er af interesse for lægemiddelindustrien til dels på grund af smertestillende, antiinflammatoriske virkninger, den kan have, når den aktiveres. I øvrigt, varianter af dets gen er blevet knyttet til en disposition for migræne, og forskere har vist, at manipulation af TRPM8 kan forårsage migrænelignende smerter hos dyr.
"TRPM8 udtrykkes også unormalt i en eller anden prostata, bryst og andre kræftformer gør det til et potentielt kemoterapeutisk mål, "Sagde Wu.
Selvom TRPM8 bedst er kendt som en perifer-nervesensor med moderat kolde temperaturer (under ca. 25 ° C) og af kolde sensationsmolekyler såsom menthol, det findes også i mange andre normale væv, selv dybt inde i kroppen, og dets funktioner i disse væv forbliver stort set uklare. En detaljeret forståelse af TRPM8's strukturelle interaktion med dets naturlige bindingspartnere bør føre til udvikling af bedre molekylære sonder, der kan hjælpe forskere med at afsløre dens forskellige funktioner.
Lander og Lee Laboratories arbejder nu på at bedre forstå, hvordan TRPM8 interagerer med menthol og andre terapeutiske bindingspartnermolekyler.
 Varme artikler
Varme artikler
-
 Ligheder i strukturen af mitokondrier og chlorplasterMitokondrier og chloroplaster er organeller, der findes i eukaryote organismer (fx organismer med en kerne). Mitokondrier og kloroplaster gør det samme arbejde - de behandler energi til cellen - men d
Ligheder i strukturen af mitokondrier og chlorplasterMitokondrier og chloroplaster er organeller, der findes i eukaryote organismer (fx organismer med en kerne). Mitokondrier og kloroplaster gør det samme arbejde - de behandler energi til cellen - men d -
 Videnskabsmand opfordrer offentligheden til at hjælpe med at låse op for gener fra truede flagermu…Den truede barbastelle flagermus. Kredit:Antton Alberdi En videnskabsmand fra University of Southampton beder om offentlighedens hjælp i hendes forsøg på at afdække de genetiske hemmeligheder om e
Videnskabsmand opfordrer offentligheden til at hjælpe med at låse op for gener fra truede flagermu…Den truede barbastelle flagermus. Kredit:Antton Alberdi En videnskabsmand fra University of Southampton beder om offentlighedens hjælp i hendes forsøg på at afdække de genetiske hemmeligheder om e -
 De første livsformer på Jorden blev afsløret i varme kilderDamp stiger fra det store kogende forår, en næsten 200-graders naturlig pool, hvor Lawrence Livermore-forskere og kolleger fra University of Nevada, Las Vegas, California State University, San Bernard
De første livsformer på Jorden blev afsløret i varme kilderDamp stiger fra det store kogende forår, en næsten 200-graders naturlig pool, hvor Lawrence Livermore-forskere og kolleger fra University of Nevada, Las Vegas, California State University, San Bernard -
 Wolbachia bakterietæthed ændres sæsonbestemt i sommerfugleSamlingspunkter (fyldte cirkler) af Z. maha i Japan. Kredit:Okayama University Overlevelse af Wolbachia - en almindelig bakterie - falder under høje temperaturer i inkubatorer. Imidlertid, få unde
Wolbachia bakterietæthed ændres sæsonbestemt i sommerfugleSamlingspunkter (fyldte cirkler) af Z. maha i Japan. Kredit:Okayama University Overlevelse af Wolbachia - en almindelig bakterie - falder under høje temperaturer i inkubatorer. Imidlertid, få unde
- Europa Clipper for at afgøre, om den iskolde måne har ingredienser, der er nødvendige for livet
- Eksperimenter på fordampning og overflade
- Fælles reduktionssugere
- Gedemælkskefir har vist sig at være godt for dit helbred
- Billeddannelse på atomniveau kunne tilbyde en køreplan for metaller med nye egenskaber
- Elektronstråle styrker genanvendelig nanokomposit


