Hvilken type binding dannes mellem bor og brint?
Her er hvorfor:
* Elektronegativitet: Bor har en elektronegativitet på 2,0, mens brint har en elektronegativitet på 2,1. Forskellen i elektronegativitet mellem dem er meget lille, hvilket betyder, at de deler elektroner næsten lige.
* Deling af elektroner: I en kovalent binding deler atomer elektroner for at opnå en stabil elektronkonfiguration. I tilfælde af bor og brint deler boratomet sine tre valenselektroner med tre hydrogenatomer, der danner et molekyle med formlen BH₃. Hvert hydrogenatom bidrager med et elektron til det delte par.
Selvom det er en kovalent binding, er det værd at bemærke, at bindingen i borhydrider ofte beskrives som en "bananbinding" På grund af den usædvanlige struktur. Dette skyldes, at boratomet kun har 6 elektroner i sin valensskal, hvilket skaber en situation, hvor elektronerne ikke er ideelt placeret til en typisk kovalent binding. Resultatet er en lidt bøjet eller bananformet binding.
Sidste artikelHvilken egenskab adskiller let svovl fra de andre faste stoffer?
Næste artikelHvorfor er carbonatomet specielt for livet?
 Varme artikler
Varme artikler
-
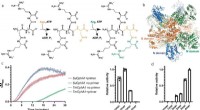 De overraskende schweizerkniv-lignende funktioner af et kraftfuldt enzymCphA1 struktur og aktivitet. a Skematisk diagram af de biosyntetiske reaktioner katalyseret af G- og M-domænerne af CphA1. b Den overordnede struktur af tetramer CphA1 fra Synechocystis sp. UTEX2470 (
De overraskende schweizerkniv-lignende funktioner af et kraftfuldt enzymCphA1 struktur og aktivitet. a Skematisk diagram af de biosyntetiske reaktioner katalyseret af G- og M-domænerne af CphA1. b Den overordnede struktur af tetramer CphA1 fra Synechocystis sp. UTEX2470 ( -
 Spiropyran-funktionaliserede fotokromiske nylonbånd til langtidsføling af ultraviolet lys(a) Snapshots af SP-funktionaliserede webbings over otte ugers UV-eksponering. (b) Tidsmæssig udvikling af webbingsets farve repræsenteret i CIE 1976-farverummet. Indsatsen er en zoomet visning, og de
Spiropyran-funktionaliserede fotokromiske nylonbånd til langtidsføling af ultraviolet lys(a) Snapshots af SP-funktionaliserede webbings over otte ugers UV-eksponering. (b) Tidsmæssig udvikling af webbingsets farve repræsenteret i CIE 1976-farverummet. Indsatsen er en zoomet visning, og de -
 Molekylære skattekort for at hjælpe med at opdage nye materialerKrystaller af et af de materialer, der blev opdaget ved hjælp af den nye metode, set med et elektronmikroskop. Dette er en struktur med en meget høj metanleveringskapacitet, hvilket gør det lovende fo
Molekylære skattekort for at hjælpe med at opdage nye materialerKrystaller af et af de materialer, der blev opdaget ved hjælp af den nye metode, set med et elektronmikroskop. Dette er en struktur med en meget høj metanleveringskapacitet, hvilket gør det lovende fo -
 Lær livet et nyt trick:Bakterier danner bor-kulstofbindingerKunstnerens fortolkning af en videnskabsmand, der introducerer bor til livets kulstofbaserede kemi. Jennifer Kan, Xiongyi Huang og deres team fra Caltech-laboratoriet hos Frances Arnold har skabt bakt
Lær livet et nyt trick:Bakterier danner bor-kulstofbindingerKunstnerens fortolkning af en videnskabsmand, der introducerer bor til livets kulstofbaserede kemi. Jennifer Kan, Xiongyi Huang og deres team fra Caltech-laboratoriet hos Frances Arnold har skabt bakt
- Sådan får du kloridioner ind i cellen
- Forskere producerer grafen ved hjælp af mikroorganismer
- Hvor ville du forvente at finde proteiner involveret i bevægelse af strukturer i en celle?
- Antag, at solen blev erstattet af en stjerne med dobbelt så meget masse, kunne jorden bane forblive…
- Hvad er atomnummeret bestemt af?
- Flere voksne bliver diagnosticeret som neurodivergerende – her er, hvordan arbejdsgivere kan hjælpe…


