Forklar, hvorfor det er vanskeligt at nøjagtigt repræsentere ammoniak to dimensionelt?
* pyramidal form: Ammoniak har en trigonal pyramidal form. Dette betyder, at nitrogenatomet er ved toppen af en pyramide, hvor de tre hydrogenatomer danner basen.
* ensomt par: Nitrogenatomet i ammoniak har et ensomt par elektroner . Dette ensomme par tager plads og påvirker molekylets form og skubber hydrogenatomerne væk fra det.
* obligationsvinkler: H-N-H-bindingsvinklerne i ammoniak er ca. 107 grader , som er mindre end de ideelle 109,5 grader, der findes i en perfekt tetrahedron. Dette skyldes frastødelsen mellem det ensomme par og bindingsparene af elektroner.
To-dimensionelle repræsentationer er ofte ikke ved at fange disse nøglefunktioner:
* enkle Lewis -strukturer: Mens Lewis -strukturer viser bindings- og ensomme par, skildrer de ikke nøjagtigt den pyramidale form eller bindingsvinkler.
* flade tegninger: En simpel tegning af ammoniak som en flad trekant med et nitrogenatom i midten og tre hydrogenatomer, der er fastgjort, kan være vildledende, da det ikke repræsenterer den ægte 3D -struktur.
For nøjagtigt at repræsentere ammoniak skal du bruge:
* Perspektivtegninger: Disse bruger linjer og vinkler til at vise dybden og formen på molekylet.
* 3D -modeller: Fysiske modeller eller computersimuleringer giver mulighed for en mere realistisk repræsentation af molekylets geometri.
Kortfattet: Den tredimensionelle struktur af ammoniak, inklusive dens pyramidale form og effekten af det ensomme par, gør det udfordrende at repræsentere nøjagtigt i to dimensioner.
Sidste artikelHvad er sulfater?
Næste artikelEr svovlsyre en sammensat blanding eller element?
 Varme artikler
Varme artikler
-
 Sortering af vira med maskinlæringEnkelte viruspartikeldetekteringer ved hjælp af en solid-state nanopore. Kredit:Osaka University Den igangværende globale pandemi har skabt et presserende behov for hurtige tests, der kan diagnost
Sortering af vira med maskinlæringEnkelte viruspartikeldetekteringer ved hjælp af en solid-state nanopore. Kredit:Osaka University Den igangværende globale pandemi har skabt et presserende behov for hurtige tests, der kan diagnost -
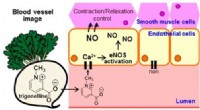 Forbindelser i monsterræddike kunne hjælpe med at tæmme hjerte-kar-sygdommeKredit:American Chemical Society Træd gulerødder til side, løg og broccoli. Den nyeste hjertesunde grøntsag kunne være en gigantisk, rekordsættende radise. I en undersøgelse, der vises i ACS Tids
Forbindelser i monsterræddike kunne hjælpe med at tæmme hjerte-kar-sygdommeKredit:American Chemical Society Træd gulerødder til side, løg og broccoli. Den nyeste hjertesunde grøntsag kunne være en gigantisk, rekordsættende radise. I en undersøgelse, der vises i ACS Tids -
 Redesigner håndsprit og donerer 7, 000 gallons til at bekæmpe COVID-19Håndsprit reddet af ethanol. Et velgørende initiativ kørte for at forhindre håndsprit i at løbe kritisk lavt over hele landet. Kredit:Georgia Tech/Christopher Moore Så mange mennesker, Seth Marder
Redesigner håndsprit og donerer 7, 000 gallons til at bekæmpe COVID-19Håndsprit reddet af ethanol. Et velgørende initiativ kørte for at forhindre håndsprit i at løbe kritisk lavt over hele landet. Kredit:Georgia Tech/Christopher Moore Så mange mennesker, Seth Marder -
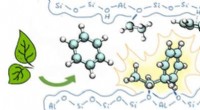 Utrecht-kemikere beviser, at nobelprisvinderen Olah har retDen grønne vej til fremstilling af råmaterialer til polystyren ud fra biomasse og bioethanol med en zeolit som katalysator. Det belyste reaktionsmellemprodukt er Wehland-komplekset. Kredit:Utrecht U
Utrecht-kemikere beviser, at nobelprisvinderen Olah har retDen grønne vej til fremstilling af råmaterialer til polystyren ud fra biomasse og bioethanol med en zeolit som katalysator. Det belyste reaktionsmellemprodukt er Wehland-komplekset. Kredit:Utrecht U
- Delhi kvæles under giftig smog, men millioner går uden masker
- Hvad er de erosionale processer i Lulworth Cove?
- Hvis vi tunnelerer gennem Jorden, hvordan ved vi så i dens centrum?
- Hvad skaber ilt blandet med klor?
- PNNL arbejder med producenter af medicinske isotoper for at sikre fortsat effektivitet af overvågni…
- Vanddamptryk Vs. Fugtighed


