Hvorfor er natriumchlorid en bedre leder af elektricitet i smeltet tilstand end fast tilstand?
solid tilstand:
* ionisk gitter: I fast tilstand eksisterer NaCl som en krystallinsk struktur med en stiv ionisk gitter. Natrium (Na+) og chlorid (Cl-) -ioner holdes tæt i faste positioner af stærke elektrostatiske kræfter.
* Ingen gratis opladningsbærere: Ionerne er låst på plads og kan ikke bevæge sig frit. Derfor er der ingen mobilafgiftsselskaber til at bære en elektrisk strøm.
* isolator: Som et resultat fungerer solid NaCl som en isolator og forhindrer strømmen af elektricitet.
smeltet tilstand:
* flydende tilstand: Når NaCl smelter, bryder den ioniske gitter ned, og ionerne bliver frit til at bevæge sig tilfældigt.
* Gratis ladningsbærere: Disse frit bevægende ioner fungerer som ladningsbærere. Når en potentiel forskel påføres, migrerer de positivt ladede natriumioner mod den negative elektrode, og de negativt ladede chloridioner migrerer mod den positive elektrode.
* ledende: Bevægelsen af disse ioner udgør en elektrisk strøm, hvilket gør smeltet NaCl til en god leder af elektricitet.
Kortfattet:
Forskellen i ledningsevne opstår fra forskellen i ionernes mobilitet. I fast tilstand er ioner immobile, mens de i den smeltede tilstand er frie til at bevæge sig, hvilket giver mulighed for strømmen af elektrisk strøm.
Sidste artikelKemisk formel for carbon IV -oxid?
Næste artikelHvordan opdagede Bunsen og Kirchhoff cæsium?
 Varme artikler
Varme artikler
-
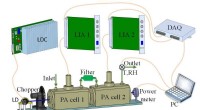 Ny sensor til måling af atmosfæriske aerosoler og nitrogendioxid samtidigtEksperimentel opsætning af D-PAS. Kredit:LIU Kun For nylig, Prof. 2 ) samtidigt. Atmosfæriske aerosoler og NO 2 betragtes som de vigtigste forurenende stoffer i luften, mens online måling af
Ny sensor til måling af atmosfæriske aerosoler og nitrogendioxid samtidigtEksperimentel opsætning af D-PAS. Kredit:LIU Kun For nylig, Prof. 2 ) samtidigt. Atmosfæriske aerosoler og NO 2 betragtes som de vigtigste forurenende stoffer i luften, mens online måling af -
 Tuningstrategier og struktureffekter af elektrokatalysatorer til kuldioxidreduktionsreaktionenForskellige afstemningsstrategier muliggør forskelle i katalysatorstrukturer. Hvordan træffer man et valg fra disse tilgængelige tuning-strategier? Der kan foretages en afvejning mellem den ønskede st
Tuningstrategier og struktureffekter af elektrokatalysatorer til kuldioxidreduktionsreaktionenForskellige afstemningsstrategier muliggør forskelle i katalysatorstrukturer. Hvordan træffer man et valg fra disse tilgængelige tuning-strategier? Der kan foretages en afvejning mellem den ønskede st -
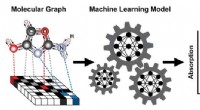 Forudsigelse af røntgenabsorptionsspektre fra graferEt skema, der viser trinene til træning af en maskinlæringsmodel til at forudsige et røntgenabsorptionsspektrum (XAS) baseret på den kendte struktur af et molekyle. Molekylets struktur er repræsentere
Forudsigelse af røntgenabsorptionsspektre fra graferEt skema, der viser trinene til træning af en maskinlæringsmodel til at forudsige et røntgenabsorptionsspektrum (XAS) baseret på den kendte struktur af et molekyle. Molekylets struktur er repræsentere -
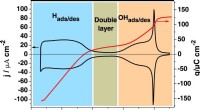 Ny forståelse af nøglebrændselscellekatalysatorTopmoderne for Pt(111). Cyklisk voltammogram (sort linje, venstre akse) og ladningstæthedskurve (rød linje, højre akse) for Pt (111) optaget i 0,1 M HClO4-opløsning ved en scanningshastighed på 50 mV
Ny forståelse af nøglebrændselscellekatalysatorTopmoderne for Pt(111). Cyklisk voltammogram (sort linje, venstre akse) og ladningstæthedskurve (rød linje, højre akse) for Pt (111) optaget i 0,1 M HClO4-opløsning ved en scanningshastighed på 50 mV
- Hvornår er gennemsnitshastigheden for et objekt ikke lig med hastigheden?
- Hvad er energitransformationen, der finder sted i et tv?
- Har granit mellemrum mellem kornene?
- Hvilke forholdsregler skal du tage under en elektrisk storm?
- For brintkraft, verdslige materialer kan være næsten lige så gode som dyr platin
- Hvad er temperaturen på 8 millioner stjerne Rigel?


