Hvad er den ioniske ligning for hydrofluorinsyre og natriumhydroxid?
1. Skriv den afbalancerede molekylære ligning:
HF (aq) + NaOH (aq) → NAF (aq) + h₂o (l)
2. Identificer de stærke elektrolytter og skriv dem som ioner:
* HF er en svag syre, så den forbliver som HF (aq).
* NaOH er en stærk base, så den adskiller sig til Na⁺ (aq) og OH⁻ (aq).
* NAF er et opløseligt salt, så det adskiller sig til Na⁺ (aq) og f⁻ (aq).
* H₂O er en svag elektrolyt og forbliver som H₂O (L).
3. Skriv den komplette ioniske ligning:
HF (aq) + Na⁺ (aq) + OH⁻ (aq) → Na⁺ (aq) + f⁻ (aq) + h₂o (l)
4. Annuller tilskuerioner:
* Na⁺ (aq) vises på begge sider af ligningen.
5. Den nettoioniske ligning er:
hf (aq) + OH⁻ (aq) → f⁻ (aq) + h₂o (l)
 Varme artikler
Varme artikler
-
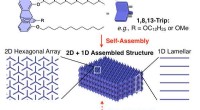 Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles
Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles -
 Forskere til at skabe galaktiske byggesten til at studere rummet mellem stjernerForskere planlægger at syntetisere en klasse af kemiske forbindelser for at afgøre, om de er en vigtig byggesten til fremstilling af galakser. Holdet fra Imperial College London har modtaget startfin
Forskere til at skabe galaktiske byggesten til at studere rummet mellem stjernerForskere planlægger at syntetisere en klasse af kemiske forbindelser for at afgøre, om de er en vigtig byggesten til fremstilling af galakser. Holdet fra Imperial College London har modtaget startfin -
 Indfanger adfærden af enkeltatom-katalysatorer på fartenEn ny undersøgelse kontrollerede præcist fastgørelsen af platinatomer (hvide kugler) til en titaniumdioxidoverflade (gitterværk af røde og blå kugler). Den fandt, at deres positioner varierede fra a
Indfanger adfærden af enkeltatom-katalysatorer på fartenEn ny undersøgelse kontrollerede præcist fastgørelsen af platinatomer (hvide kugler) til en titaniumdioxidoverflade (gitterværk af røde og blå kugler). Den fandt, at deres positioner varierede fra a -
 Nikkelkatalysator letter oprettelsen af en enkelt stereoisomer med to kirale centreAlkyl-alkylbindingsdannelse. (A) Katalysatorstyret stereoselektivitet-tidligere arbejde. (B) Katalysatorstyret stereoselektivitet-denne undersøgelse. ee, enantiomert overskud; M, metal; R, substituent
Nikkelkatalysator letter oprettelsen af en enkelt stereoisomer med to kirale centreAlkyl-alkylbindingsdannelse. (A) Katalysatorstyret stereoselektivitet-tidligere arbejde. (B) Katalysatorstyret stereoselektivitet-denne undersøgelse. ee, enantiomert overskud; M, metal; R, substituent


