Et element E har elektronkonfigurationen KR 5S2 Formlen for fluorforbindelse er sandsynligvis?
1. Identificer elementet:
* Elektronkonfigurationen KR 5S² fortæller os, at elementet E er i den samme gruppe som Krypton (gruppe 18, ædelgasser).
* Da den har en elektronkonfiguration, der slutter på 5S², er E i den anden række af denne gruppe.
* Dette element er strontium (SR) .
2. Bestem ionafgiften:
* Strontium er et gruppe 2 -element, hvilket betyder, at det har en tendens til at miste 2 elektroner for at opnå en stabil ædelgaskonfiguration.
* Dette resulterer i en +2 opladning:SR²⁺
3. Bestem fluorionionen:
* Fluor er et gruppe 17 -element, hvilket betyder, at det har en tendens til at få et elektron for at opnå en stabil ædelgaskonfiguration.
* Dette resulterer i en -1 -afgift:F⁻
4. Kombiner ionerne:
* For at danne en neutral forbindelse skal ionerne afbalancere.
* Du har brug for to fluorioner (2 x -1 =-2) for at afbalancere +2 -ladningen af strontiumionen.
5. Formlen:
* Formlen for fluorforbindelsen af strontium er srf₂ .
Sidste artikelHvor mange valenselektroner har metan diazoniumion?
Næste artikelHvad sker der, når klorgas tilsættes til vand?
 Varme artikler
Varme artikler
-
 Nyt værktøj udviklet til at diagnosticere og overvåge autoimmune lidelserKredit:Daria Sokol/MIPT Forskere fra Prokhorov General Physics Institute ved Det Russiske Videnskabsakademi og Moskva Institut for Fysik og Teknologi har udviklet en ny metode til diagnosticering
Nyt værktøj udviklet til at diagnosticere og overvåge autoimmune lidelserKredit:Daria Sokol/MIPT Forskere fra Prokhorov General Physics Institute ved Det Russiske Videnskabsakademi og Moskva Institut for Fysik og Teknologi har udviklet en ny metode til diagnosticering -
 Naturligt silica-baseret pesticid beskytter afgrøder i opbevaring og kan fjerne giftig fosfinKredit:petrmalinak, Shutterstock Majs, hvede og ris udgør 90 procent af kornproduktionen globalt, og omkring 40 procent af alle kalorier i forbrugt mad. Men op til halvdelen af de høstede korn,
Naturligt silica-baseret pesticid beskytter afgrøder i opbevaring og kan fjerne giftig fosfinKredit:petrmalinak, Shutterstock Majs, hvede og ris udgør 90 procent af kornproduktionen globalt, og omkring 40 procent af alle kalorier i forbrugt mad. Men op til halvdelen af de høstede korn, -
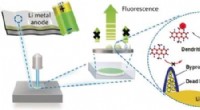 Fluorescensprobe viser fordelingen af aktive lithiumarter på lithiummetalanoderKredit:Wiley Batterier med metalliske lithium-anoder giver forbedret effektivitet sammenlignet med konventionelle lithium-ion-batterier på grund af deres højere kapacitet. Imidlertid, sikkerhedshe
Fluorescensprobe viser fordelingen af aktive lithiumarter på lithiummetalanoderKredit:Wiley Batterier med metalliske lithium-anoder giver forbedret effektivitet sammenlignet med konventionelle lithium-ion-batterier på grund af deres højere kapacitet. Imidlertid, sikkerhedshe -
 Direkte syntese af azulen fortsætter med at afsløre lokkende egenskaberDen blå farve er svær at observere i sin krystalform. Azulene udsender en lugt, der ligner mølkugler. Kredit:Shinshu University Azulen er et ret pænt stof. Som navnet antyder, det viser en ejendom
Direkte syntese af azulen fortsætter med at afsløre lokkende egenskaberDen blå farve er svær at observere i sin krystalform. Azulene udsender en lugt, der ligner mølkugler. Kredit:Shinshu University Azulen er et ret pænt stof. Som navnet antyder, det viser en ejendom


