Hvilken ladning ville en svovlion have?
Her er hvorfor:
* Svovls elektronkonfiguration: Svovl har 16 elektroner. Dens elektronkonfiguration er 2-8-6. Dette betyder, at det har 6 elektroner i sin yderste skal.
* octet regel: Atomer har en tendens til at vinde eller miste elektroner for at opnå en stabil konfiguration med 8 elektroner i deres yderste skal (oktetreglen).
* At vinde elektroner: Svovl kan opnå en stabil oktet ved at vinde 2 elektroner. Dette giver det en -2 ladning, hvilket gør det til en sulfidion (S 2 - ).
 Varme artikler
Varme artikler
-
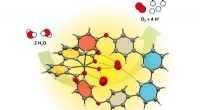 Kunstigt enzym opdeler vand mere effektivtEnzymlignende vandfororganisering foran en Ruthenium-vandoxidationskatalysator. Kredit:Würthner-gruppen / Würzburg Universitet Menneskeheden står over for en central udfordring:Den skal klare overg
Kunstigt enzym opdeler vand mere effektivtEnzymlignende vandfororganisering foran en Ruthenium-vandoxidationskatalysator. Kredit:Würthner-gruppen / Würzburg Universitet Menneskeheden står over for en central udfordring:Den skal klare overg -
 At bytte vand til CO2 kan gøre fracking grønnere og mere effektivtEn skiferprøve klar til brud med CO2. Kredit:Xuehang Song Forskere ved det kinesiske videnskabsakademi og China University of Petroleum (Beijing) har påvist, at CO 2 kan give en bedre hydraulisk
At bytte vand til CO2 kan gøre fracking grønnere og mere effektivtEn skiferprøve klar til brud med CO2. Kredit:Xuehang Song Forskere ved det kinesiske videnskabsakademi og China University of Petroleum (Beijing) har påvist, at CO 2 kan give en bedre hydraulisk -
 Brug af radikaliserede NOₓ-derivater understøttet på metaloxiderGrafisk billede af forskningen. Kredit:Korea Institute of Science and Technology (KIST) INGEN x (X=1 eller 2), der udsendes fra papirvarer/mobilkilder, anses traditionelt for at være berygtede,
Brug af radikaliserede NOₓ-derivater understøttet på metaloxiderGrafisk billede af forskningen. Kredit:Korea Institute of Science and Technology (KIST) INGEN x (X=1 eller 2), der udsendes fra papirvarer/mobilkilder, anses traditionelt for at være berygtede, -
 Forskere opfinder metode til at frigøre potentialet for meget brugt medicinKredit:CC0 Public Domain Sukkerarter som polysaccharider findes overalt i naturen og menes at være afgørende for, at der opstår liv. Hos mennesker, de dækker overfladen af alle celler og familie
Forskere opfinder metode til at frigøre potentialet for meget brugt medicinKredit:CC0 Public Domain Sukkerarter som polysaccharider findes overalt i naturen og menes at være afgørende for, at der opstår liv. Hos mennesker, de dækker overfladen af alle celler og familie
- Tørke på Afrikas Horn:Forskning viser, hvordan et netværk af grundvandsboringer kunne hjælpe
- Hvad er den grundlæggende kraft, der er ansvarlig for erosion?
- Nanoskala optisk switch bryder miniaturiseringsbarrieren
- Smart nanopartikel viser, at intermitterende faste kan beskytte hjertet mod skader under kemoterapi
- Er kvartsit en stødende klippe eller sedimentær klippe?
- Hvad har solen at gøre med ElectectMagntic Spectrum?


