Den korrekte Lewis -struktur for et molekyle af forbindelsen C2H2 indeholder?
1. Tæl de samlede valenselektroner:
* Carbon (C) har 4 valenselektroner hver, så 2 C -atomer bidrager med 2 * 4 =8 elektroner.
* Hydrogen (H) har 1 valenselektron hver, så 2 timers atomer bidrager med 2 * 1 =2 elektroner.
* Samlede valenselektroner:8 + 2 =10
2. Bestem det centrale atom:
* Kulstof er mindre elektronegativ end brint, så det vil være det centrale atom.
3. Tilslut atomerne med enkeltbindinger:
* Placer de to carbonatomer ved siden af hinanden, og tilslut hvert carbonatom til et hydrogenatom med en enkelt binding.
4. Fuldfør octets omkring atomerne (undtagen brint):
* Hvert carbonatom har i øjeblikket kun 3 elektroner. For at opnå et oktet skal hvert carbonatom danne en tredobbelt binding med det andet carbonatom. Dette bruger de resterende 4 valenselektroner.
5. Den sidste Lewis -struktur:
* Den sidste Lewis -struktur af C₂H₂ har en tredobbelt binding mellem de to carbonatomer og en enkelt binding mellem hvert kulstof og et hydrogenatom.
Her er repræsentationen:
`` `
H
|
H - C ≡ C - H
`` `
nøglefunktioner i strukturen:
* Hvert carbonatom har en fuld oktet (8 elektroner).
* Hvert hydrogenatom har 2 elektroner (en duet).
* Molekylet er lineært.
* Den tredobbelte binding mellem carbonatomerne er meget stærk og giver acetylen sine unikke egenskaber.
Sidste artikelHvad har været virkning af opvarmning af natriumchlorid?
Næste artikelHvilken ladning ville en svovlion have?
 Varme artikler
Varme artikler
-
 Forskere finder værdi i usædvanlig type plantematerialeKredit:CC0 Public Domain Et ideelt bioraffinaderi ville forvandle vedvarende afgrøder til en række forskellige brændstoffer og produkter med lidt affald. En væsentlig udfordring i at realisere den
Forskere finder værdi i usædvanlig type plantematerialeKredit:CC0 Public Domain Et ideelt bioraffinaderi ville forvandle vedvarende afgrøder til en række forskellige brændstoffer og produkter med lidt affald. En væsentlig udfordring i at realisere den -
 Plastic upcycling:Fra affald til brændstof for mindrePlastaffald kan en dag blive upcyclet til brugbare råvarekemikalier i stedet for at ende i miljøet. Kredit:Cortland Johnson, Pacific Northwest National Laboratory En plastgenbrugsinnovation, der gø
Plastic upcycling:Fra affald til brændstof for mindrePlastaffald kan en dag blive upcyclet til brugbare råvarekemikalier i stedet for at ende i miljøet. Kredit:Cortland Johnson, Pacific Northwest National Laboratory En plastgenbrugsinnovation, der gø -
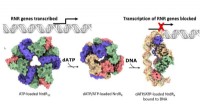 Ny mekanisme til regulering af forsyningen af DNA-byggesten til bedre antibiotikaVirkningsmekanismen af den RNR-specifikke repressor NrdR. Overfladerepræsentation af cryo-EM-kortene for de dodecameriske, oktamere og DNA-bundne tetramere NrdR-strukturer. NrdR-monomerer i hver tet
Ny mekanisme til regulering af forsyningen af DNA-byggesten til bedre antibiotikaVirkningsmekanismen af den RNR-specifikke repressor NrdR. Overfladerepræsentation af cryo-EM-kortene for de dodecameriske, oktamere og DNA-bundne tetramere NrdR-strukturer. NrdR-monomerer i hver tet -
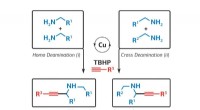 Chemist foreslår ny metode til at syntetisere prækursorer til Parkinsons-lægemidlerKredit:RUDN Universitet En kemiker fra RUDN University har foreslået en ny metode til syntese af sekundær propargylamin, der bruges til at skabe antidepressiva, medicin mod Parkinsons sygdom og an
Chemist foreslår ny metode til at syntetisere prækursorer til Parkinsons-lægemidlerKredit:RUDN Universitet En kemiker fra RUDN University har foreslået en ny metode til syntese af sekundær propargylamin, der bruges til at skabe antidepressiva, medicin mod Parkinsons sygdom og an
- Hvad er excentriciteten af bane omkring solen?
- Hvilken by er nærmest 40degree n breddegrad og 77 -grader med længdegrad?
- Hvad næsten alle sprog har til fælles - uanset om du taler eller tegner
- Ny bog udforsker, hvordan skoler kan forberede eleverne på en usikker fremtid
- Hvad er Boyles lov, og hvorfor ved jeg det allerede?
- Hvorfor er celleoversættelse nødvendig?


