Ny mekanisme til regulering af forsyningen af DNA-byggesten til bedre antibiotika
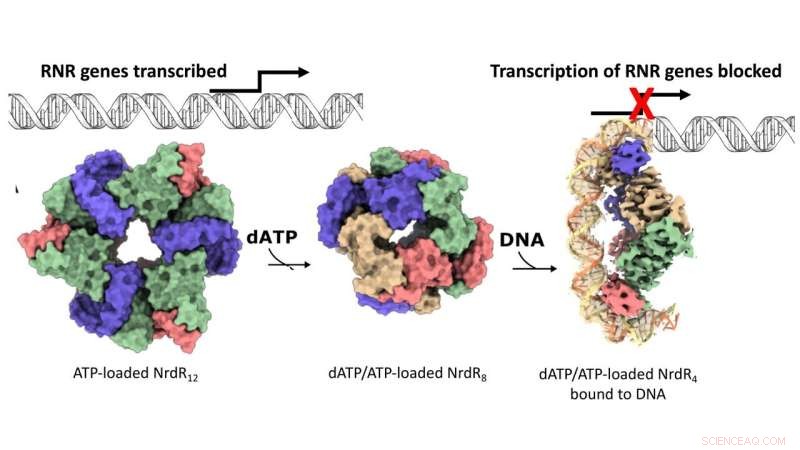
Virkningsmekanismen af den RNR-specifikke repressor NrdR. Overfladerepræsentation af cryo-EM-kortene for de dodecameriske, oktamere og DNA-bundne tetramere NrdR-strukturer. NrdR-monomerer i hver tetramer-samling er farvet beige, blå, grøn og pink. DNA er vist skematisk, bortset fra den del, der er løst ved cryo-EM, hvor de to antiparallelle DNA-strenge er henholdsvis orange og lysegule. Kredit:Inna Rozman Grinberg
I en ny undersøgelse offentliggjort i Nature Communications , viser forskere fra Stockholm Universitet for første gang, hvordan NrdR binder til DNA for at hæmme RNR. Den nye mekanisme kunne hjælpe forskere med at designe bedre antibiotika ved at målrette mod et patogens evne til at reproducere.
"Vi opdagede NrdR for mere end et årti siden, men den måde, det fungerer på, var en gåde. I denne artikel kombinerede vi biokemiske og strukturelle undersøgelser for at finde ud af, hvordan NrdR binder til DNA," siger Inna Rozman Grinberg, forsker ved Institut for Biokemi og Biofysisk ved Stockholms Universitet og hovedforfatter af undersøgelsen.
DNA-syntese er processen med at skabe nye DNA-molekyler, der finder sted, når en celle deler sig. I stort set alle levende organismer udgør enzymet ribonukleotidreduktase (RNR) byggesten til de nye DNA-strenge. I mange bakterier, herunder velkendte patogener såsom Mycobacterium tuberculosis, er syntese af RNR slået fra af repressorproteinet NrdR. Imidlertid forblev mekanismen, der understøtter samspillet mellem RNR og NrdR, uhåndgribelig. Generelt, når bakterieceller deler sig, aktiveres RNR for at give byggesten til fremstilling af nyt DNA. I mellemtiden forbliver NrdR slukket. Derefter, når DNA-syntesen er færdig, binder NrdR til DNA, hvilket forhindrer yderligere syntese af RNR.
Men hvordan mærker cellerne, hvornår det er tid til at slukke for RNR? Svaret ligger i det relative koncentrationsforhold mellem to nøglemolekyler, nemlig adenosintriphosphat (ATP) og deoxyadenosintriphosphat (dATP). Forskerne viste, at nogle RNR'er kan slukke sig selv, når der er høje dATP-niveauer. NrdR binder på den anden side kun til DNA og hæmmer syntesen af RNR, når dATP-niveauerne er høje. Denne følemekanisme, som næsten udelukkende bruges af RNR og NrdR, formidles via et proteindomæne kaldet "ATP-kegle."
"Denne mekanisme fremhæver et spændende aspekt af proteinudvikling," siger Inna Rozman Grinberg.
Ifølge Inna Rozman Grinberg, da NrdR er rigeligt i bakterier, men fraværende hos mennesker, kunne ATP-keglen bruges som et antibiotisk mål mod patogener med en enkelt RNR eller mod patogener med NrdR til at kontrollere alle deres RNR'er. "Så vidt vi ved, er dette det eneste eksempel på et evolutionært mobilt proteindomæne, der kontrollerer både ekspression og aktivitet af et enzym." + Udforsk yderligere
RNR 'switch' giver håb i kampen mod antibiotikaresistente bakterier
 Varme artikler
Varme artikler
-
 Sådan beregnes masseforholdI kemi er masseforhold, ofte kaldet procentvis sammensætning efter masse, andelen af et bestemt molekyle, der består af hvert af molekylets bestanddele. For eksempel består vand af 11,1 procent b
Sådan beregnes masseforholdI kemi er masseforhold, ofte kaldet procentvis sammensætning efter masse, andelen af et bestemt molekyle, der består af hvert af molekylets bestanddele. For eksempel består vand af 11,1 procent b -
 Annotationsværktøj giver et skridt i retning af at forstå sammenhænge mellem sygdom, mutant RNADette er en computergrafik af et RNA-molekyle. Kredit:Richard Feldmann/Wikipedia Forskere ved Oregon State University har udviklet et computerprogram, der repræsenterer et vigtigt skridt mod bedre
Annotationsværktøj giver et skridt i retning af at forstå sammenhænge mellem sygdom, mutant RNADette er en computergrafik af et RNA-molekyle. Kredit:Richard Feldmann/Wikipedia Forskere ved Oregon State University har udviklet et computerprogram, der repræsenterer et vigtigt skridt mod bedre -
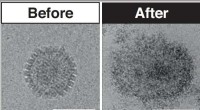 Unik ny antiviral behandling fremstillet ved hjælp af sukkerVirucidbehandling før og efter. Kredit:University of Manchester Nye antivirale materialer fremstillet af sukker er udviklet til at ødelægge vira ved kontakt og kan hjælpe i kampen mod virusudbrud.
Unik ny antiviral behandling fremstillet ved hjælp af sukkerVirucidbehandling før og efter. Kredit:University of Manchester Nye antivirale materialer fremstillet af sukker er udviklet til at ødelægge vira ved kontakt og kan hjælpe i kampen mod virusudbrud. -
 Amorf diamant syntetiseretAtomstruktur af diamant (venstre) sammenlignet med amorf diamant (højre). Diamant er krystallinsk og anisotropisk, hvilket betyder, at dens egenskaber er retningsbestemte. Den enkeltkrystallinske diam
Amorf diamant syntetiseretAtomstruktur af diamant (venstre) sammenlignet med amorf diamant (højre). Diamant er krystallinsk og anisotropisk, hvilket betyder, at dens egenskaber er retningsbestemte. Den enkeltkrystallinske diam
- Kigger under motorhjelmen på falske nyhedsdetektorer
- Kuldioxid fodrer planter, men er jordens planter ved at blive fulde?
- Hvad er fordelene ved hornets?
- United slutter sig til Southwest, Amerikansk i ny 737 MAX forsinkelse
- Forskere søger klimaændringernes hellige gral i Omans bakker
- Udryddelse af koldtvandskoraller på den namibiske sokkel på grund af lavt iltindhold


