Hvad har været virkning af opvarmning af natriumchlorid?
1. Lave temperaturer (under 801 ° C):
* Ingen væsentlig ændring: Natriumchlorid er en stabil forbindelse med et højt smeltepunkt. Ved temperaturer under dets smeltepunkt findes det simpelthen som et fast stof.
2. Smeltningspunkt (801 ° C):
* faseændring: På sit smeltepunkt overgår natriumchlorid fra et fast stof til en væske. Dette er en fysisk ændring, ikke en kemisk ændring.
3. Høje temperaturer (over 801 ° C):
* flydende tilstand: Natriumchlorid forbliver i en smeltet flydende tilstand.
* fordampning: Hvis temperaturen øges yderligere, vil natriumchlorid i sidste ende begynde at fordampe og ændre sig fra en væske til en gas.
* Nedbrydning: Ved ekstremt høje temperaturer (over 1400 ° C) kan natriumchlorid begynde at nedbrydes i dets bestanddele, natrium (NA) og chlor (CL). Imidlertid opnås denne nedbrydning ikke let under standardlaboratorieforhold.
Vigtig note:
Mens natriumchlorid er stabilt ved de fleste temperaturer, kan eksponering for meget høje temperaturer i nærvær af visse stoffer forårsage reaktioner. For eksempel:
* reaktion med fugt: Hvis det opvarmes i nærvær af fugt, kan natriumchlorid reagere med vand til dannelse af natriumhydroxid (NaOH) og hydrogenchlorid (HCI), der frigiver ætsende dampe.
* reaktion med andre materialer: Når det opvarmes i kontakt med visse metaller eller metaloxider, kan natriumchlorid gennemgå kemiske reaktioner, hvilket fører til dannelse af nye forbindelser.
Kortfattet:
Opvarmning af natriumchlorid forårsager primært faseændringer - fra fast til væske og derefter potentielt til gas - ved stigende temperaturer. Selvom det er relativt stabilt, kan det reagere med andre stoffer under specifikke forhold.
Sidste artikelHvilken forbindelse er ALP?
Næste artikelDen korrekte Lewis -struktur for et molekyle af forbindelsen C2H2 indeholder?
 Varme artikler
Varme artikler
-
 Lad europium skinne klarereEuropium Eu(III)-komplekset med nanocarbon-antenne, der udsender fint rødt lys. Kredit:WPI-ICReDD, Hokkaido Universitet En stablet nanocarbonantenne får et sjældent jordelement til at skinne 5 gan
Lad europium skinne klarereEuropium Eu(III)-komplekset med nanocarbon-antenne, der udsender fint rødt lys. Kredit:WPI-ICReDD, Hokkaido Universitet En stablet nanocarbonantenne får et sjældent jordelement til at skinne 5 gan -
 DNA -enzymer kunne udkonkurrere proteinenzymer til genteknologiKemiprofessor Yi Lu ledede et team, der udviklede en teknik, der tillader DNA-enzymer at skære dobbeltstrenget DNA, muliggøre en bred vifte af gentekniske applikationer. Kredit:L. Brian Stauffer F
DNA -enzymer kunne udkonkurrere proteinenzymer til genteknologiKemiprofessor Yi Lu ledede et team, der udviklede en teknik, der tillader DNA-enzymer at skære dobbeltstrenget DNA, muliggøre en bred vifte af gentekniske applikationer. Kredit:L. Brian Stauffer F -
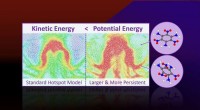 Forskning afdækker manglende fysik i eksplosive hotspotsMolekylær dynamik simuleringer forudsiger, at mere potentiel energi er lokaliseret i hotspots, end deres kinetiske energi (eller temperatur) antyder. Overskydende potentiel energi er bundet til vedvar
Forskning afdækker manglende fysik i eksplosive hotspotsMolekylær dynamik simuleringer forudsiger, at mere potentiel energi er lokaliseret i hotspots, end deres kinetiske energi (eller temperatur) antyder. Overskydende potentiel energi er bundet til vedvar -
 Bibliotek af edderkoppesilke kunne rumme hemmeligheder for nye materialerSølvhaveedderkopper (Argiope argentata) sidder i deres spind i Cheryl Hayashis laboratorium på American Museum of Natural History i New York. Edderkoppesilker starter alle på samme måde:en klud goo, b
Bibliotek af edderkoppesilke kunne rumme hemmeligheder for nye materialerSølvhaveedderkopper (Argiope argentata) sidder i deres spind i Cheryl Hayashis laboratorium på American Museum of Natural History i New York. Edderkoppesilker starter alle på samme måde:en klud goo, b
- Kvindelige forskere, der forandrede verden
- Hvordan pyramiderne fungerer
- Tjekkiske orner stadig radioaktive 31 år efter Tjernobyl
- Antallet af forskellige elementer i den kemiske formel for mineral scapolit Na2ca2al3Si9O24Cl?
- Sådan bestemmes Shock Spring Rate
- Bevis på påvirkninger, der strukturerede Mælkevejsgalaksen


