Hvorfor kræves lave temperaturer og høje tryk for flydende klorgas?
forståelse af det grundlæggende
* Gasser vs. væsker: Den største forskel mellem en gas og en væske ligger i styrken af de intermolekylære kræfter (IMF'er) mellem molekyler. I gasser er IMF'er meget svage, hvilket giver molekyler mulighed for at bevæge sig frit. I væsker er IMF'er stærkere og holder molekyler tættere sammen.
* kinetisk energi: Molekyler i et stof er altid i bevægelse. Denne bevægelse, kendt som kinetisk energi, øges med temperaturen.
* tryk: Trykket er i det væsentlige den kraft, der udøves af molekylerne af et stof mod en beholder.
flydende klorgas
1. lave temperaturer:
* Ved høje temperaturer har klormolekyler en masse kinetisk energi. De bevæger sig hurtigt og overvinder de svage IMF'er, der holder dem sammen.
* Sænkning af temperaturen reducerer molekylernes kinetiske energi. Dette gør det muligt for de svage IMF'er at have en større indflydelse, hvilket trækker molekylerne tættere sammen og fremmer kondens til en flydende tilstand.
2. Højt tryk:
* Stigende tryk tvinger klormolekylerne tættere sammen. Denne trængsel øger hyppigheden af kollisioner og giver de svage IMF'er mulighed for at udøve en større indflydelse.
* Derudover reducerer højtrykket det tilgængelige volumen for gasmolekylerne til at bevæge sig rundt og fremme yderligere kondens.
Kortfattet:
* Lave temperaturer reducerer klormolekylernes kinetiske energi, hvilket gør det muligt for de svage IMF'er at trække dem tættere sammen.
* Højt tryk tvinger molekylerne nærmere, hvilket øger sandsynligheden for interaktion mellem dem og styrker IMF'ernes indflydelse.
Kombinationen af disse faktorer fører i sidste ende til flydende af klorgas.
Sidste artikelHvilken partikel findes ikke i brint?
Næste artikelH2O CO2 og NaCl er alle eksempler på hvad?
 Varme artikler
Varme artikler
-
 Kobber-doteret zinksulfid ændrer farve reversibelt, når det er belyst og kan bruges i smarte adapt…Forskere har opdaget hurtigt skiftende fotokromisme i et billigt uorganisk materiale:kobber-doterede zinksulfid nanokrystaller. Deres resultater baner vejen for et væld af potentielle applikationer li
Kobber-doteret zinksulfid ændrer farve reversibelt, når det er belyst og kan bruges i smarte adapt…Forskere har opdaget hurtigt skiftende fotokromisme i et billigt uorganisk materiale:kobber-doterede zinksulfid nanokrystaller. Deres resultater baner vejen for et væld af potentielle applikationer li -
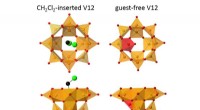 Flipped metaloxidbur kan sortere kuldioxid fra kulilteAnionstrukturer af CH 2 Cl 2 (gæst)-indsat V12 (venstre) og gæstefri V12 er vist. Orange og røde firkantede pyramider repræsenterer VO 5 enheder med deres baser rettet mod midten af skålen, og
Flipped metaloxidbur kan sortere kuldioxid fra kulilteAnionstrukturer af CH 2 Cl 2 (gæst)-indsat V12 (venstre) og gæstefri V12 er vist. Orange og røde firkantede pyramider repræsenterer VO 5 enheder med deres baser rettet mod midten af skålen, og -
 Flappende vinger drevet af solenDenne lille fløj kunne en dag bruges i robotter eller enheder til at høste solenergi. Kredit:American Chemical Society I oldgræsk mytologi, Icarus voksvinger smeltede, da han turde flyve for tæt p
Flappende vinger drevet af solenDenne lille fløj kunne en dag bruges i robotter eller enheder til at høste solenergi. Kredit:American Chemical Society I oldgræsk mytologi, Icarus voksvinger smeltede, da han turde flyve for tæt p -
 Formindskelse af et kemikalies kulstofaftryk i hverdagsgenstandeMIT-forskere brugte disse manganoxid-nanopartikler til at katalysere nedbrydningen af vand og den efterfølgende inkorporering af ilt i nyttige forbindelser kaldet epoxider. Kredit:researchers/MIT
Formindskelse af et kemikalies kulstofaftryk i hverdagsgenstandeMIT-forskere brugte disse manganoxid-nanopartikler til at katalysere nedbrydningen af vand og den efterfølgende inkorporering af ilt i nyttige forbindelser kaldet epoxider. Kredit:researchers/MIT
- Marokkanske safranbønder kæmper mod knockoff-krydderier
- Træer bliver højteknologiske:Processen gør cellulose til energilagringsenheder
- Hvilken fase har mest energi?
- Hvad er størst 1500 ml eller 1,5 L?
- BIG Bell Test - Globalt fysikeksperiment udfordrer Einstein ved hjælp af 100, 000 frivillige
- Hvad er absorptionshastigheden?


