Formindskelse af et kemikalies kulstofaftryk i hverdagsgenstande
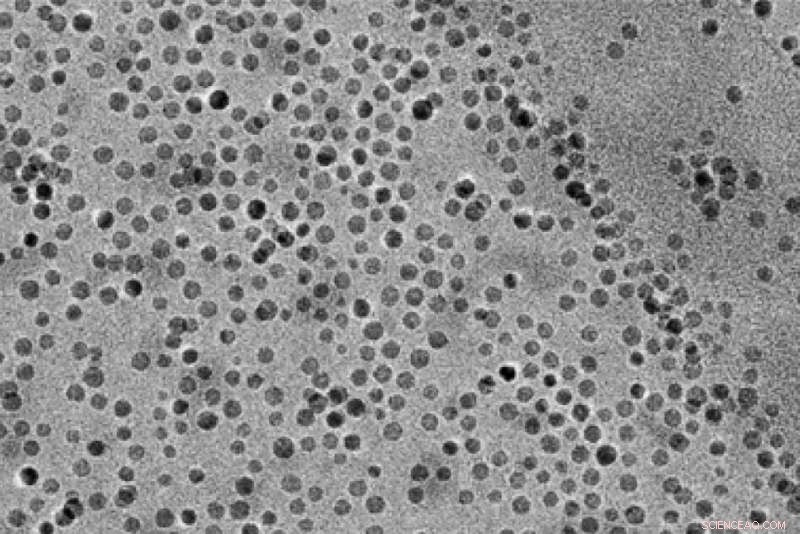
MIT-forskere brugte disse manganoxid-nanopartikler til at katalysere nedbrydningen af vand og den efterfølgende inkorporering af ilt i nyttige forbindelser kaldet epoxider. Kredit:researchers/MIT
Den største kilde til globalt energiforbrug er industriel fremstilling af produkter som plastik, jern, og stål. Ikke alene kræver fremstilling af disse materialer enorme mængder energi, men mange af reaktionerne udsender også direkte kuldioxid som et biprodukt.
I et forsøg på at hjælpe med at reducere dette energiforbrug og de relaterede emissioner, MIT kemiingeniører har udtænkt en alternativ tilgang til syntetisering af epoxider, en type kemikalie, der bruges til at fremstille forskellige produkter, inklusive plast, lægemidler, og tekstiler. Deres nye tilgang, som bruger elektricitet til at køre reaktionen, kan gøres ved stuetemperatur og atmosfærisk tryk, mens kuldioxid som et biprodukt elimineres.
"Hvad man ikke ofte indser, er, at det industrielle energiforbrug er langt større end transport eller boligforbrug. Dette er elefanten i rummet, og der har været meget få tekniske fremskridt med hensyn til at kunne reducere det industrielle energiforbrug, " siger Karthish Manthiram, en adjunkt i kemiteknik og seniorforfatter til det nye studie.
Forskerne har søgt patent på deres teknik, og de arbejder nu på at forbedre effektiviteten af syntesen, så den kan tilpasses til storskala, industriel brug.
MIT postdoc Kyoungsuk Jin er hovedforfatter af papiret, som vises online 9. april i Journal of the American Chemical Society . Andre forfattere omfatter kandidatstuderende Joseph Maalouf, Nikifar Lazouski, og Nathan Corbin, og postdoc Dengtao Yang.
Allestedsnærværende kemikalier
Epoxider, hvis vigtigste kemiske egenskab er en treleddet ring bestående af et oxygenatom bundet til to carbonatomer, bruges til at fremstille så forskellige produkter som frostvæske, rengøringsmidler, og polyester.
"Det er umuligt at gå i selv en kort periode af sit liv uden at røre eller føle eller bære noget, der på et tidspunkt i sin historie har involveret en epoxid. De er allestedsnærværende, " siger Manthiram. "De er så mange forskellige steder, men vi har en tendens til ikke at tænke på den indlejrede energi og kuldioxid-fodaftrykket."
Adskillige epoxider er blandt kemikalierne med de største kulstofaftryk. Produktionen af et almindeligt epoxid, ethylenoxid, genererer den femtestørste kuldioxidemission af ethvert kemisk produkt.
Fremstilling af epoxider kræver mange kemiske trin, og de fleste af dem er meget energikrævende. For eksempel, reaktionen bruges til at binde et iltatom til ethylen, producerer ethylenoxid, skal ske ved næsten 300 grader Celsius og under tryk 20 gange større end atmosfærisk tryk. Desuden, det meste af den energi, der bruges til at drive denne form for fremstilling, kommer fra fossile brændstoffer.
Forøgelse af CO2-fodaftrykket, reaktionen, der bruges til at producere ethylenoxid, genererer også kuldioxid som et biprodukt, som slippes ud i atmosfæren. Andre epoxider fremstilles ved hjælp af en mere kompliceret tilgang, der involverer farlige peroxider, som kan være eksplosiv, og calciumhydroxid, som kan forårsage hudirritation.
For at komme med en mere bæredygtig tilgang, MIT-holdet tog inspiration fra en reaktion kendt som vandoxidation, som bruger elektricitet til at spalte vand til ilt, protoner, og elektroner. De besluttede at prøve at udføre vandoxidationen og derefter binde oxygenatomet til en organisk forbindelse kaldet en olefin, som er en forløber for epoxider.
Dette var en kontraintuitiv tilgang, Manthiram siger, fordi olefiner og vand normalt ikke kan reagere med hinanden. Imidlertid, de kan reagere med hinanden, når der påføres en elektrisk spænding.
For at drage fordel af dette, MIT-teamet designede en reaktor med en anode, hvor vand nedbrydes til oxygen, hydrogenioner (protoner), og elektroner. Manganoxid-nanopartikler fungerer som en katalysator for at hjælpe denne reaktion med, og at inkorporere oxygenet i en olefin til fremstilling af et epoxid. Protoner og elektroner strømmer til katoden, hvor de omdannes til brintgas.
Termodynamisk, denne reaktion kræver kun omkring 1 volt elektricitet, mindre end spændingen på et standard AA-batteri. Reaktionen genererer ikke kuldioxid, og forskerne forventer, at de yderligere kan reducere CO2-fodaftrykket ved at bruge elektricitet fra vedvarende kilder som sol eller vind til at drive epoxidkonverteringen.
Opskalere
Indtil nu, forskerne har vist, at de kan bruge denne proces til at skabe et epoxid kaldet cyclooctenoxid, og de arbejder nu på at tilpasse den til andre epoxider. De forsøger også at gøre omdannelsen af olefiner til epoxider mere effektiv - i denne undersøgelse, omkring 30 procent af den elektriske strøm gik ind i konverteringsreaktionen, men de håber at fordoble det.
De vurderer, at deres proces, hvis opskaleret, kunne producere ethylenoxid til en pris på $900 pr. ton, sammenlignet med $1, 500 pr. ton ved brug af de nuværende metoder. Disse omkostninger kan sænkes yderligere, efterhånden som processen bliver mere effektiv. En anden faktor, der kunne bidrage til den økonomiske levedygtighed af denne tilgang, er, at den også genererer brint som et biprodukt, som er værdifuld i sig selv til at drive brændselsceller.
Forskerne planlægger at fortsætte med at udvikle teknologien i håb om på sigt at kommercialisere den til industriel brug, og de arbejder også på at bruge elektricitet til at syntetisere andre slags kemikalier.
"Der er mange processer, der har enorme kuldioxid-fodaftryk, og dekarbonisering kan drives af elektrificering, Manthiram siger. "Man kan eliminere temperatur, eliminere tryk, og brug spænding i stedet."
 Varme artikler
Varme artikler
-
 Ny teknik til at skabe super-svampe er en game changerForskere har udtænkt nye metoder til postsyntetisk modifikation af metal-organiske rammer for at producere egenskaber i materialet, der er ideelt til gasmanipulation. Kredit:DGIST Metal-organiske
Ny teknik til at skabe super-svampe er en game changerForskere har udtænkt nye metoder til postsyntetisk modifikation af metal-organiske rammer for at producere egenskaber i materialet, der er ideelt til gasmanipulation. Kredit:DGIST Metal-organiske -
 Et periodisk system med molekylære knuderHvilke nye knudetyper vil det være muligt at realisere i fremtiden? Dette er det udfordrende spørgsmål, som SISSA -forskere, i samarbejde med University of Padua, har tacklet ved hjælp af computersimu
Et periodisk system med molekylære knuderHvilke nye knudetyper vil det være muligt at realisere i fremtiden? Dette er det udfordrende spørgsmål, som SISSA -forskere, i samarbejde med University of Padua, har tacklet ved hjælp af computersimu -
 I et felt, hvor mindre er bedre, forskere opdager verdens mindste antistofferFuldstændig struktur af et antistof, viser dens domæner. Kredit:University of Bath Forskere ved University of Bath i Storbritannien og biofarmavirksomheden UCB har fundet en måde at producere mini
I et felt, hvor mindre er bedre, forskere opdager verdens mindste antistofferFuldstændig struktur af et antistof, viser dens domæner. Kredit:University of Bath Forskere ved University of Bath i Storbritannien og biofarmavirksomheden UCB har fundet en måde at producere mini -
 Fremtidens blæk inden for trykt elektronikPolymer blæk. Den blå er donorpolymeropløsningen, mens den røde er acceptorpolymeropløsningen. Begge uberørte polymerer er ikke-ledende, fordi der ikke er frie bevægelige ladninger inde i polymererne.
Fremtidens blæk inden for trykt elektronikPolymer blæk. Den blå er donorpolymeropløsningen, mens den røde er acceptorpolymeropløsningen. Begge uberørte polymerer er ikke-ledende, fordi der ikke er frie bevægelige ladninger inde i polymererne.


