Hvad er definitionen af binær molekylær forbindelse?
Her er en sammenbrud af de vigtigste egenskaber:
* binær: Forbindelsen er sammensat af kun to elementer.
* molekylær: Elementerne holdes sammen af kovalente obligationer , hvor atomer deler elektroner.
* ikke -metaller: Begge involverede elementer klassificeres som ikke -metaller. Dette er en vigtig sondring fra ioniske forbindelser, der er dannet af et metal og et ikke -metal.
Eksempler på binære molekylære forbindelser:
* kuldioxid (co₂): Carbon og ilt er begge ikke -metaller.
* vand (H₂O): Hydrogen og ilt er begge ikke -metaller.
* ammoniak (NH₃): Nitrogen og brint er begge ikke -metaller.
* methan (ch₄): Carbon og brint er begge ikke -metaller.
nøglefunktioner ved binære molekylære forbindelser:
* Lav smeltnings- og kogepunkter: Sammenlignet med ioniske forbindelser har de svagere intermolekylære kræfter.
* ofte gasser eller væsker ved stuetemperatur: Deres svage bindinger gør dem mere tilbøjelige til at eksistere i disse faser.
* dårlige ledere af elektricitet: Kovalente obligationer giver ikke let mulighed for bevægelse af ladning.
Bemærk: Mens langt de fleste binære molekylære forbindelser dannes fra to ikke -metaller, er der undtagelser. Nogle forbindelser med en metalloid (som bor) og en ikke -metal kan også klassificeres som molekylære forbindelser.
 Varme artikler
Varme artikler
-
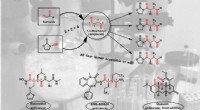 Når svovl forsvinder sporløstNy selektiv syntese af alle 1, 4-dicarbonylisomerer fra sulfoxider og udvalgte vigtige bioaktive forbindelser med 1, 4-dicarbonylmotiv. Kredit:© Maulide Group Mange naturprodukter og lægemidler ha
Når svovl forsvinder sporløstNy selektiv syntese af alle 1, 4-dicarbonylisomerer fra sulfoxider og udvalgte vigtige bioaktive forbindelser med 1, 4-dicarbonylmotiv. Kredit:© Maulide Group Mange naturprodukter og lægemidler ha -
 Riller holder løfte om sofistikeret helbredelseRice University forsker Maryam Elizondo har et 3D-printet stillads graveret med riller til aflejring af levende celler til implantation. Stilladset letter væksten af nye væv, når det nedbrydes. Ved
Riller holder løfte om sofistikeret helbredelseRice University forsker Maryam Elizondo har et 3D-printet stillads graveret med riller til aflejring af levende celler til implantation. Stilladset letter væksten af nye væv, når det nedbrydes. Ved -
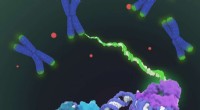 Langt søgt struktur af telomerase baner vej for nye lægemidler til aldring, KræftVist er den rumfyldende model af human telomerase-holoenzymstruktur bestemt ved kryo-elektronmikroskopi (cryo-EM). Telomerase katalyserer syntesen af telomerisk DNA (grøn) i enderne af kromosomerne
Langt søgt struktur af telomerase baner vej for nye lægemidler til aldring, KræftVist er den rumfyldende model af human telomerase-holoenzymstruktur bestemt ved kryo-elektronmikroskopi (cryo-EM). Telomerase katalyserer syntesen af telomerisk DNA (grøn) i enderne af kromosomerne -
 Forskere producerer omkostningseffektive, miljøvenligt glasmaterialeKomplekse strukturer af transparent smeltet silica fremstillet via sprøjtestøbning af den nyudviklede Glassomer-komposit. Kredit:Glassomer GmbH Glas er allestedsnærværende i højteknologiske produk
Forskere producerer omkostningseffektive, miljøvenligt glasmaterialeKomplekse strukturer af transparent smeltet silica fremstillet via sprøjtestøbning af den nyudviklede Glassomer-komposit. Kredit:Glassomer GmbH Glas er allestedsnærværende i højteknologiske produk
- Hvilken energi bruger en vaskemaskine?
- Forskere identificerer nøglemekanismer, nye materialer til biologisk inspireret informationsbehandl…
- Hvornår produceres elektrokemisk energi?
- Ved hvilken slags pladegrænse forekommer de fleste undervandsvulkaner?
- USA ser på alternative sanktioner for Chinas ZTE:Ross
- Hvilken type magma producerer eyjafjallajokull?


