Når 200,2 g svovl reagerer med 100,3 klor for at producere disulfur diclorid fungerer som den begrænsende reaktant?
1. Skriv den afbalancerede kemiske ligning:
S + Cl₂ → S₂cl₂
2. Konverter masser til mol:
* svovl (er):
* Molmasse på S =32,06 g/mol
* Mol S =200,2 g / 32,06 g / mol =6,24 mol
* klor (cl₂):
* Molmasse af Cl₂ =70,90 g/mol
* Mol Cl₂ =100,3 g / 70,90 g / mol =1,41 mol
3. Bestem molforholdet fra den afbalancerede ligning:
Den afbalancerede ligning viser et forhold på 1:1 mol mellem svovl (er) og klor (CL₂). Dette betyder for hver 1 mol S, du har brug for 1 mol Cl₂ for at reagere fuldstændigt.
4. Identificer den begrænsende reaktant:
* svovl: Du har 6,24 mol S.
* klor: Du har 1,41 mol cl₂.
Da du har mindre klor (1,41 mol) end svovl (6,24 mol), er klor den begrænsende reaktant. Du har ikke nok klor til at reagere fuldstændigt med alt svovl.
Derfor er klor (CL₂) den begrænsende reaktant.
 Varme artikler
Varme artikler
-
 Massespektrometri kaster nyt lys over thalliumforgiftende cold caseHårprøver fra offeret monteres på objektglas til analyse ved massespektrometri. Kredit:Faye Levine I 1994, Den kinesiske universitetsstuderende Zhu Ling begyndte at opleve mavesmerter, hårtab og d
Massespektrometri kaster nyt lys over thalliumforgiftende cold caseHårprøver fra offeret monteres på objektglas til analyse ved massespektrometri. Kredit:Faye Levine I 1994, Den kinesiske universitetsstuderende Zhu Ling begyndte at opleve mavesmerter, hårtab og d -
 Lærere laver Frankensteel under Materials Camp på MITLærer Jody Matta hælder en tinlegering i en form for at skabe en Frankensteel på MIT Materials Genome Camp. Kredit:Julian Rackwitz, MIT Ti gymnasielærere tilbragte en uge på MIT i juli med at desig
Lærere laver Frankensteel under Materials Camp på MITLærer Jody Matta hælder en tinlegering i en form for at skabe en Frankensteel på MIT Materials Genome Camp. Kredit:Julian Rackwitz, MIT Ti gymnasielærere tilbragte en uge på MIT i juli med at desig -
 Ny symmetri-brydende metode åbner vej for bioaktive forbindelserEn demonstration af molekylær chiralitet ved hjælp af 3-D atommodeller i laboratoriet. Kredit:J. Waser/EPFL Mange kemiske molekyler kan eksistere i naturen sammen med deres spejlmodstykker; som hæ
Ny symmetri-brydende metode åbner vej for bioaktive forbindelserEn demonstration af molekylær chiralitet ved hjælp af 3-D atommodeller i laboratoriet. Kredit:J. Waser/EPFL Mange kemiske molekyler kan eksistere i naturen sammen med deres spejlmodstykker; som hæ -
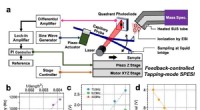 Vil du diagnosticere hjernesygdomme? En massespektrometri -billeddannelse kan en dag hjælpe digFigur 1:(a) Skematisk af målesystemet udviklet i denne undersøgelse. Ved at bruge denne teknologi, udvinding og ionisering af picolitervolumener kan udføres uden forstyrrelser forårsaget af overflader
Vil du diagnosticere hjernesygdomme? En massespektrometri -billeddannelse kan en dag hjælpe digFigur 1:(a) Skematisk af målesystemet udviklet i denne undersøgelse. Ved at bruge denne teknologi, udvinding og ionisering af picolitervolumener kan udføres uden forstyrrelser forårsaget af overflader
- Nye globale temperaturdata vil informere undersøgelse af klimaeffekter på sundhed, landbrug
- Robotter med klæbrige fødder kan klatre op, ned, og rundt omkring
- Svulmende Europa seler til toppen af rekordvarmebølge
- Peru opdager i en grav før Incan for 16 kinesiske migranter
- Hvad er den endosymbiotiske teori?
- Hvad afslutter en planet en af disse hverdag?


