Hvor meget varme absorberes af 100 ml af en fortyndet opløsning NH4NO3, når den ændrer sin temp fra 25,3 Celsius til 22,4 Celsius?
1. Bestem temperaturændringen
* ΔT =endelig temperatur - starttemperatur
* ΔT =22,4 ° C - 25,3 ° C =-2,9 ° C
2. Bestem massen af løsningen
* Hvis man antager, at densiteten af den fortyndede opløsning er ca. 1 g/ml (tæt på vandets densitet), er massen af opløsningen:
* Masse =volumen x densitet =100 ml x 1 g/ml =100 g
3. Bestem den specifikke varmekapacitet i opløsningen
* Den specifikke varmekapacitet af en fortyndet ammoniumnitratopløsning er omtrent den samme som vandet, som er 4.184 J/(G · ° C).
4. Beregn den absorberede varme
* Formlen til beregning af varme, der er absorberet, er:
* Q =m x c x ΔT
* Hvor:
* Q =varme absorberet (i joule)
* m =masse af opløsningen (i gram)
* c =specifik varmekapacitet (i j/(g · ° C))
* ΔT =ændring i temperatur (i ° C)
* Tilslutning af værdierne:
* Q =100 g x 4,184 J/(g · ° C) x -2,9 ° C
* Q =-1213,76 J
Vigtig note: Det negative tegn indikerer, at varme er * frigivet * af løsningen, ikke absorberet. Dette skyldes, at temperaturen på opløsningen faldt.
Derfor frigav løsningen ca. 1213,76 Joules of Heat.
Sidste artikelHvad er ordet ligning af kaliumhydroxid og svovlsyre?
Næste artikelHvad er klorreaktivitet med vand?
 Varme artikler
Varme artikler
-
 Forskere udvikler Venus fluefanger bio-sensorer for at fange forurenende stofferForskningen præsenteres som et hot paper og er også udvalgt som tidsskriftets forsideillustration. Kredit:Wiley Forskere fra Trinity har skabt en række nye biologiske sensorer ved kemisk at ombygg
Forskere udvikler Venus fluefanger bio-sensorer for at fange forurenende stofferForskningen præsenteres som et hot paper og er også udvalgt som tidsskriftets forsideillustration. Kredit:Wiley Forskere fra Trinity har skabt en række nye biologiske sensorer ved kemisk at ombygg -
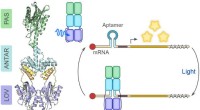 Blåt lys til RNA -kontrolFotoreceptoren PAL binder korte ribonukleinsyrer ved bestråling af blåt lys. Denne lysstyrede aktivitet kan bruges til at regulere RNA-baserede processer, såsom translation. Kredit:© Andreas Möglich/U
Blåt lys til RNA -kontrolFotoreceptoren PAL binder korte ribonukleinsyrer ved bestråling af blåt lys. Denne lysstyrede aktivitet kan bruges til at regulere RNA-baserede processer, såsom translation. Kredit:© Andreas Möglich/U -
 Papir eller plastik? Stiv vandtæt belægning til papir har til formål at reducere vores afhængigh…En klassisk origami-kran lavet af papir og belagt med Choetsu (venstre) og ubestrøget (højre). Når den er nedsænket i vand, holder den belagte papirkran sin form, mens den ubestrøede hurtigt mættes me
Papir eller plastik? Stiv vandtæt belægning til papir har til formål at reducere vores afhængigh…En klassisk origami-kran lavet af papir og belagt med Choetsu (venstre) og ubestrøget (højre). Når den er nedsænket i vand, holder den belagte papirkran sin form, mens den ubestrøede hurtigt mættes me -
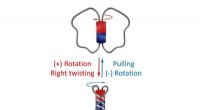 Alle afviklede:En reversibel molekylær hvirvelDenne molekylære hvirvel kan vrides reversibelt, og forskere kan måle dens kræfter. Kredit:Tilpasset fra Journal of the American Chemical Society (2022), DOI:10.1021/jacs.2c02547 I løbet af de sids
Alle afviklede:En reversibel molekylær hvirvelDenne molekylære hvirvel kan vrides reversibelt, og forskere kan måle dens kræfter. Kredit:Tilpasset fra Journal of the American Chemical Society (2022), DOI:10.1021/jacs.2c02547 I løbet af de sids
- Byggeriet af Europas exoplanetjæger PLATO begynder
- Patienters individuelle genomer kan påvirke effektiviteten, sikkerhed ved genredigering
- Fremmed liv i vores solsystem? Undersøg hints om Saturns moon
- Forsker finder ud af, at genskabelse af tillid til regeringen kan hjælpe med at begrænse kriser so…
- Hvad siger du, at kemi lever hjemme?
- Hvad er spændende ved fysik?


