Hvorfor har ammonium en positiv ladning?
1. nitrogens elektronegativitet: Nitrogen er mere elektronegativ end brint. Dette betyder, at det tiltrækker elektroner stærkere i en kovalent binding. I ammoniumion trækker nitrogen de delte elektroner tættere på sig selv og skaber en delvis negativ ladning på nitrogen og delvis positive ladninger på hydrogenerne.
2. nitrogens ensomme par: Nitrogen har fem valenselektroner og danner tre kovalente bindinger med hydrogenatomer i ammoniak (NH₃). Dette efterlader et ensomt par elektroner på nitrogen.
3. Protonation: Når ammoniak reagerer med en proton (H⁺), tiltrækkes protonen af det ensomme par på nitrogen. Dette resulterer i dannelsen af en fjerde kovalent binding mellem nitrogen og protonen.
4. formel afgift: På grund af tilsætning af proton og deling af elektronparret har nitrogenatomet i ammonium fire bindinger og ingen ensomme par. Dette giver nitrogen en formel ladning på +1.
5. samlet afgift: Ammoniumionen har en nettopositiv ladning, fordi +1 ladning på nitrogen opvejer de fire +1/4 ladninger på hydrogenerne.
Sammenfattende opstår den positive ladning på ammonium fra kombinationen af nitrogens elektronegativitet, tilstedeværelsen af et ensomt par på nitrogen og tilsætning af en proton til at danne en fjerde kovalent binding.
Sidste artikelHvad er valency of Cesium?
Næste artikelHvad er formlen for sammensat NH4 og CO3?
 Varme artikler
Varme artikler
-
 Elektrokemi åbner vej til en bæredygtig kilde til sulfonamider for lægemiddelproducenterSulfonamidholdige lægemidler. Kredit:Sulfonamidholdige lægemidler. Kredit: Et forskerhold ved Johannes Gutenberg University Mainz (JGU) i Tyskland har udviklet en helt ny, miljøvenlig elektrokemisk
Elektrokemi åbner vej til en bæredygtig kilde til sulfonamider for lægemiddelproducenterSulfonamidholdige lægemidler. Kredit:Sulfonamidholdige lægemidler. Kredit: Et forskerhold ved Johannes Gutenberg University Mainz (JGU) i Tyskland har udviklet en helt ny, miljøvenlig elektrokemisk -
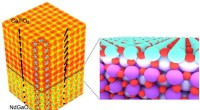 En 3D-billeddannelsesteknik låser egenskaber ved perovskitkrystaller opEn rekonstruktion af en perovskitkrystal (CaTiO3) dyrket på et lignende perovskit -substrat (NdGaO3), der viser elektrontæthed og iltoktaedrisk tilt. (indsæt) Kunstners opfattelse af grænsefladen mell
En 3D-billeddannelsesteknik låser egenskaber ved perovskitkrystaller opEn rekonstruktion af en perovskitkrystal (CaTiO3) dyrket på et lignende perovskit -substrat (NdGaO3), der viser elektrontæthed og iltoktaedrisk tilt. (indsæt) Kunstners opfattelse af grænsefladen mell -
 Automatiseret pipeline forbedrer adgangen til avancerede mikroskopidataKredit:CC0 Public Domain En ny databehandlingstilgang skabt af forskere ved University of Michigan Life Sciences Institute tilbyder en enklere, hurtigere vej til data genereret af kryo-elektronmik
Automatiseret pipeline forbedrer adgangen til avancerede mikroskopidataKredit:CC0 Public Domain En ny databehandlingstilgang skabt af forskere ved University of Michigan Life Sciences Institute tilbyder en enklere, hurtigere vej til data genereret af kryo-elektronmik -
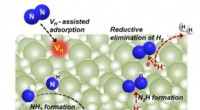 Overgangsmetalfrit bariumhydrid medierer dinitrogenfiksering og ammoniaksynteseOvergangsmetalfri dinitrogenfiksering medieret af bariumhydrid. Kredit:Guan Yeqin Ammoniak er afgørende for fremstillingen af kvælstofgødning. På grund af det høje energiforbrug ved industriel am
Overgangsmetalfrit bariumhydrid medierer dinitrogenfiksering og ammoniaksynteseOvergangsmetalfri dinitrogenfiksering medieret af bariumhydrid. Kredit:Guan Yeqin Ammoniak er afgørende for fremstillingen af kvælstofgødning. På grund af det høje energiforbrug ved industriel am
- Har mindre massestjerner en større lysstyrke end større stjerner?
- Hvad kalder du bevægelsen mod midt i kroppen?
- Hvad er forskellen mellem kinetisk energi og potentiel energi?
- En kønslinse er afgørende for at opretholde fred:Beviser fra Mozambique
- Sådan oprettes en orkan til et videnskabsprojekt
- At vinde på sociale medier er sandsynligvis enklere, end du tror


