Hvad sker der, når en metallisk oxid opløses i vand?
1. Grundlæggende oxider:
* reaktion: Grundlæggende oxider som natriumoxid (Na₂O) og calciumoxid (CAO) reagerer med vand for at danne metalhydroxider, som er grundlæggende.
* Eksempel:
* Na₂o + H₂O → 2NAOH (natriumhydroxid)
* CAO + H₂O → CA (OH) ₂ (calciumhydroxid)
* Løsning: Opløsningen bliver grundlæggende (alkalisk) med en pH -værdi på større end 7.
2. Sure oxider:
* reaktion: Sure oxider som svovltrioxid (SO₃) og fosforpentoxid (P₂O₅) reagerer med vand for at danne syrer.
* Eksempel:
* SO₃ + H₂O → H₂SO₄ (svovlsyre)
* P₂O₅ + 3H₂O → 2H₃po₄ (fosforsyre)
* Løsning: Opløsningen bliver sur med en pH mindre end 7.
3. Amfoteriske oxider:
* reaktion: Amfoteriske oxider som aluminiumoxid (Al₂O₃) og zinkoxid (ZnO) kan reagere med både syrer og baser.
* Eksempel:
* Al₂o₃ + 6HCl → 2Alcl₃ + 3H₂O (reaktion med syre)
* Al₂o₃ + 2NAOH + 3H₂O → 2NA [AL (OH) ₄] (reaktion med base)
* Løsning: Opløsningen kan være sur, grundlæggende eller neutral afhængigt af forholdene.
4. Andre faktorer:
* opløselighed: Ikke alle metalliske oxider er opløselige i vand. Nogle, som jernoxid (Fe₂o₃) er i det væsentlige uopløselige.
* Temperatur: Opløseligheden af de fleste metalliske oxider øges med temperaturen.
* ph: Opløsningens pH kan påvirke opløseligheden af visse metalliske oxider.
Kortfattet:
Reaktionen af et metallisk oxid med vand afhænger af metalens art. Grundlæggende oxider danner hydroxider, sure oxider danner syrer, og amfoteriske oxider kan reagere med begge. Opløseligheden og andre faktorer spiller også en rolle i den samlede reaktion.
 Varme artikler
Varme artikler
-
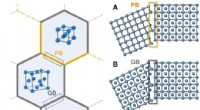 Brug af kemisk grænseteknik til at skabe stål, der er stærkt og fleksibelt uden højt kulstofindh…Skematisk illustration af en PB, en GB, og en CB. (A) PB, en grænse mellem to korn af forskellig gittertype. (B) GB, en grænse mellem to korn af samme gittertype, men med forskellige krystallografiske
Brug af kemisk grænseteknik til at skabe stål, der er stærkt og fleksibelt uden højt kulstofindh…Skematisk illustration af en PB, en GB, og en CB. (A) PB, en grænse mellem to korn af forskellig gittertype. (B) GB, en grænse mellem to korn af samme gittertype, men med forskellige krystallografiske -
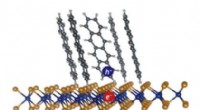 Hurtigt bevægende elektroner skaber strøm i organiske solcellerEn exciton (elektron-hul-par) dannet ved grænsefladen mellem tetracen-molekyler (en organisk halvleder) og enkeltlags WS2 (en uorganisk halvleder). Dissociation af sådanne grænseflade excitoner er nød
Hurtigt bevægende elektroner skaber strøm i organiske solcellerEn exciton (elektron-hul-par) dannet ved grænsefladen mellem tetracen-molekyler (en organisk halvleder) og enkeltlags WS2 (en uorganisk halvleder). Dissociation af sådanne grænseflade excitoner er nød -
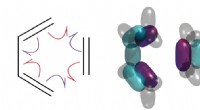 Teoretikere beviser endelig, at krøllede pile fortæller sandheden om kemiske reaktionerDiels-Alder-reaktionen er vigtig i syntesen af alle slags lægemidler, herunder D-vitamin. Men hvordan virker det? UNSW-forskere viser, at det involverer spaltning af elektronpar. Kredit:T. Schmidt
Teoretikere beviser endelig, at krøllede pile fortæller sandheden om kemiske reaktionerDiels-Alder-reaktionen er vigtig i syntesen af alle slags lægemidler, herunder D-vitamin. Men hvordan virker det? UNSW-forskere viser, at det involverer spaltning af elektronpar. Kredit:T. Schmidt -
 Konvertering af solenergi til brintbrændstof, med hjælp fra fotosynteseKredit:CC0 Public Domain Global økonomisk vækst kommer med stigende efterspørgsel efter energi, men at øge energiproduktionen kan være udfordrende. For nylig, forskere har opnået rekordeffektivite
Konvertering af solenergi til brintbrændstof, med hjælp fra fotosynteseKredit:CC0 Public Domain Global økonomisk vækst kommer med stigende efterspørgsel efter energi, men at øge energiproduktionen kan være udfordrende. For nylig, forskere har opnået rekordeffektivite
- At studere Fraunhofer -linjer hjælper med at identificere, hvad der på stjernerne?
- Nedbrydende plast afsløres som kilde til drivhusgasser
- Hvorfor er nitrogen langt mindre reaktivt ilten?
- Energiressourcerne i den industrielle revolution
- Hvilket er mere opløseligt i rent vand ved stuetemperatur blynitrat eller sulfat?
- Hvad er den afbalancerede nukleare ligning for reaktion, hvor zirconium-97 gennemgår beta-forfald?


