Hvad er massen af en molatomer?
Den specifikke molmasse afhænger dog af det element, du taler om.
Her er hvorfor:
* molmasse er massen af en mol af et stof. En mol er en måleenhed, der repræsenterer 6,022 x 10^23 partikler (som atomer, molekyler eller ioner).
* Hvert element har en anden atommasse. Dette er den gennemsnitlige masse af et atom af dette element, målt i atommasseenheder (AMU).
* den molære masse af et element er numerisk lig med dets atommasse. Men i stedet for at blive målt i AMU, måles det i gram pr. Mol (g/mol).
for eksempel:
* carbon (c): Atommassen af kulstof er cirka 12 amu. Derfor er den molære masse af kulstof 12 g/mol. Dette betyder, at en mol carbonatomer vejer 12 gram.
* ilt (O): Atommassen af ilt er ca. 16 amu. Så den molære masse af ilt er 16 g/mol. En mol iltatomer vejer 16 gram.
For at finde massen af en mol atomer til et specifikt element skal du blot slå sin atommasse op på den periodiske tabel. Dette antal, i gram pr. Mol, er dets molære masse
 Varme artikler
Varme artikler
-
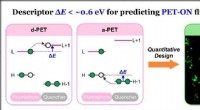 Generel beskrivelse sætter gang i fremskridt inden for farvestofkemiForskere fra SUTD, DICP, og POSTECH udviklede en teoretisk deskriptor ΔE til at forudsige PET-baserede fluorescensprober; ved at bruge denne deskriptor, de designede kvantitativt fluorescerende plette
Generel beskrivelse sætter gang i fremskridt inden for farvestofkemiForskere fra SUTD, DICP, og POSTECH udviklede en teoretisk deskriptor ΔE til at forudsige PET-baserede fluorescensprober; ved at bruge denne deskriptor, de designede kvantitativt fluorescerende plette -
 Membranteknologi kan reducere emissioner og energiforbrug i olieraffineringNy membranteknologi kan reducere kulstofemissioner og energiintensitet i forbindelse med raffinering af råolie. Georgia Tech lektor Ryan Lively viser et modul, der indeholder det nye membranmateriale,
Membranteknologi kan reducere emissioner og energiforbrug i olieraffineringNy membranteknologi kan reducere kulstofemissioner og energiintensitet i forbindelse med raffinering af råolie. Georgia Tech lektor Ryan Lively viser et modul, der indeholder det nye membranmateriale, -
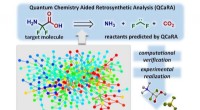 Ny computer-assisteret kemisk syntesemetode reducerer forskningstid og omkostningerDen nye beregningsmetode muliggør retrosyntetisk analyse, der søger efter nedbrydningsveje for et ønsket produkt, før man foreslår syntetiske veje på en omvendt måde. Kredit:Tsuyoshi Mita, Yu Harabuch
Ny computer-assisteret kemisk syntesemetode reducerer forskningstid og omkostningerDen nye beregningsmetode muliggør retrosyntetisk analyse, der søger efter nedbrydningsveje for et ønsket produkt, før man foreslår syntetiske veje på en omvendt måde. Kredit:Tsuyoshi Mita, Yu Harabuch -
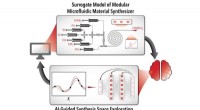 Virtuelt laboratorium finder det rigtige AI-værktøj til hvert kemiproblemKredit:North Carolina State University At have det rigtige værktøj til jobbet gør arbejdet meget lettere, billigere og hurtigere. Kemiingeniørforskere har nu udviklet et virtuelt laboratorium, der
Virtuelt laboratorium finder det rigtige AI-værktøj til hvert kemiproblemKredit:North Carolina State University At have det rigtige værktøj til jobbet gør arbejdet meget lettere, billigere og hurtigere. Kemiingeniørforskere har nu udviklet et virtuelt laboratorium, der
- Hvad er den kumulative virkning af kræfter på objekter bevægelse?
- Unikt jernalderskjold giver indsigt i forhistorisk teknologi
- Livet som planetregulator:Forskere foreslår en eksperimentel test
- Forskere viser sammenhængen mellem trawl og klimaændringer i Nordsøen
- Producerer USA mest energi?
- NASA-forskere skændes om, hvordan man netværker det ydre rum


