Hvorfor er alle carbon-carbonbindingslængder i benzen lige?
1. benzens struktur: Benzen har en ring med seks carbonatomer, der hver er bundet til et hydrogenatom. Standardrepræsentationen af benzen viser skiftende enkelt- og dobbeltbindinger:
`` `
H
\
C
/ \
H c
\ /
C
/ \
H c
\ /
C
/ \
H h
`` `
2. delokaliserede elektroner: Dobbeltbindingerne i benzen er ikke fastgjort i position. I stedet delokaliseres de elektroner, der er involveret i dobbeltbindingerne, på tværs af hele ringen. Dette betyder, at elektronerne deles lige af alle seks carbonatomer.
3. Resonansstrukturer: Vi kan repræsentere denne delokalisering ved at tegne to resonansstrukturer, hvor dobbeltbindingerne forskydes:
`` `
H
\
C
/ \
H c
\ /
C =
/ \
H c
\ /
C =
/ \
H h
`` `
og
`` `
H
\
C =
/ \
H c
\ /
C
/ \
H c =
\ /
C
/ \
H h
`` `
4. Lige bindingslængder: Fordi elektronerne er delokaliseret, og dobbeltbindingerne konstant skifter, er alle kulstof-carbonbindinger i benzen i det væsentlige mellemliggende mellem en enkelt og en dobbeltbinding. Dette resulterer i, at alle seks obligationer har samme længde, som er kortere end en enkelt obligation, men længere end en dobbeltobligation.
Kortfattet: Delokaliseringen af elektroner i benzen gennem resonans fører til de lige carbon-carbonbindingslængder.
 Varme artikler
Varme artikler
-
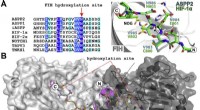 Hydroxyleringen af ASPP2 og andre ankyrin-gentagelsesdomæneproteinerUdsigter fra krystalstrukturer af FIH i kompleks med ASPP-afledte peptider. En (venstre) sekvensjustering af ASPP-proteiner med rapporterede FIH-substrater. (Højre) Overlejring af krystalstrukturafled
Hydroxyleringen af ASPP2 og andre ankyrin-gentagelsesdomæneproteinerUdsigter fra krystalstrukturer af FIH i kompleks med ASPP-afledte peptider. En (venstre) sekvensjustering af ASPP-proteiner med rapporterede FIH-substrater. (Højre) Overlejring af krystalstrukturafled -
 Undgå madforurening med en holdbar belægning til hårde overfladerEn ny undersøgelse fra University of Missouri viser, at en holdbar belægning - fremstillet af titandioxid - er i stand til at fjerne fødevarebårne bakterier, såsom salmonella og E. coli, og giver et f
Undgå madforurening med en holdbar belægning til hårde overfladerEn ny undersøgelse fra University of Missouri viser, at en holdbar belægning - fremstillet af titandioxid - er i stand til at fjerne fødevarebårne bakterier, såsom salmonella og E. coli, og giver et f -
 Samarbejdet forskning kan føre til forbedringer i produktionen af kulfiberKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Infrarød (IR) billedteknologi ved den australske Synchrotron, udviklet specielt til kulfiberanalyse, har bidraget til en bedre
Samarbejdet forskning kan føre til forbedringer i produktionen af kulfiberKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Infrarød (IR) billedteknologi ved den australske Synchrotron, udviklet specielt til kulfiberanalyse, har bidraget til en bedre -
 Kemiske bølger guider til fremtidens katalysatorerSpiralstrukturer på krystallen. Kredit:TU Wien Spektakulære elektronmikroskopbilleder på TU Wien fører til vigtige fund:Kemiske reaktioner kan producere spirallignende multi-frekvensbølger og derm
Kemiske bølger guider til fremtidens katalysatorerSpiralstrukturer på krystallen. Kredit:TU Wien Spektakulære elektronmikroskopbilleder på TU Wien fører til vigtige fund:Kemiske reaktioner kan producere spirallignende multi-frekvensbølger og derm
- Hvad bruges enheden til at måle strålende energi?
- Hvordan påvirker vanderosion og deponering en klippe?
- Hvordan kan havet give os ren energi?
- Hvor mange inches er der i 1,4 meter?
- Hvad har den største indflydelse på potentiel energi på et objekt?
- En ny type infrarøde polaritoner på overfladen af bulkkrystaller


