Hvad er sandt med elektronerne i en svovlion?
* Svovlioner kan enten være negativt eller positivt ladet. Svovl kan vinde eller miste elektroner til dannelse af ioner.
* En svovlion med en negativ ladning (en anion) har flere elektroner end et neutralt svovlatom. Et neutralt svovlatom har 16 elektroner. For eksempel har en sulfidion (S⁻²) vundet to elektroner, der bringer det samlede beløb til 18.
* En svovlion med en positiv ladning (en kation) har færre elektroner end et neutralt svovlatom. For eksempel har en svovlkation (s²⁺) mistet to elektroner, hvilket bringer det samlede beløb til 14.
Forståelse af svovlens elektronkonfiguration:
* Svovlens atomnummer er 16, hvilket betyder, at det har 16 protoner og 16 elektroner i sin neutrale tilstand.
* Dens elektronkonfiguration er 2, 8, 6. Dette betyder, at den har 6 elektroner i sin yderste skal (valenselektroner), der er involveret i kemisk binding.
Nøglepunkt: Antallet af elektroner i en svovlion vil altid være forskelligt fra et neutralt svovlatom, afhængigt af om det har vundet eller mistet elektroner.
Sidste artikelDen formelle ladning af nitrogen i nitrationen?
Næste artikelHvordan adskiller den molekylære formel ikke sig fra N2O?
 Varme artikler
Varme artikler
-
 Lego-lignende kemiske byggeklodser samler sig selv til katalysator til brintbrændselscellerDen nye katalysator, en cofacial kobolt porphyrin, er skabt ved hjælp af en proces kaldet molekylær selvsamling. Under denne proces, et hætteglas fyldt med molekyler kaldet koboltporphyriner (hættegla
Lego-lignende kemiske byggeklodser samler sig selv til katalysator til brintbrændselscellerDen nye katalysator, en cofacial kobolt porphyrin, er skabt ved hjælp af en proces kaldet molekylær selvsamling. Under denne proces, et hætteglas fyldt med molekyler kaldet koboltporphyriner (hættegla -
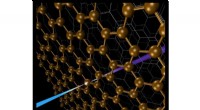 Ny sonde til hemmelighederne ved komplekse grænsefladerForskere har udtænkt en spektroskopi-metode - baseret på blød røntgen-anden-harmonisk generation - der sonderer begravede grafenlag inde i grafit. Kredit:US Department of Energy I genopladelige ba
Ny sonde til hemmelighederne ved komplekse grænsefladerForskere har udtænkt en spektroskopi-metode - baseret på blød røntgen-anden-harmonisk generation - der sonderer begravede grafenlag inde i grafit. Kredit:US Department of Energy I genopladelige ba -
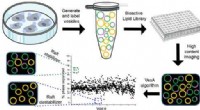 Biokemisk teknik til at finde små molekyler opdaget af forskereGrafisk abstrakt. Kredit:ACS Central Science (2022). DOI:10.1021/acscentsci.1c01058 Lipid-flåder, en komponent af plasmamembranerne, der omgiver alle celler i den menneskelige krop, er essentielle
Biokemisk teknik til at finde små molekyler opdaget af forskereGrafisk abstrakt. Kredit:ACS Central Science (2022). DOI:10.1021/acscentsci.1c01058 Lipid-flåder, en komponent af plasmamembranerne, der omgiver alle celler i den menneskelige krop, er essentielle -
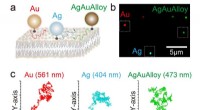 Hurtig og præcis flerfarvebilleddannelse af biomolekyler nu muligBrugen af guld, sølv og guld-sølv legering nanopartikler tillod højhastigheds/høj præcision flerfarve billeddannelse for første gang. Kredit:Ryota Iino, Institut for Molekylær Videnskab, National In
Hurtig og præcis flerfarvebilleddannelse af biomolekyler nu muligBrugen af guld, sølv og guld-sølv legering nanopartikler tillod højhastigheds/høj præcision flerfarve billeddannelse for første gang. Kredit:Ryota Iino, Institut for Molekylær Videnskab, National In
- Hvordan er insekter til gavn for mennesker?
- Hvordan er energien fra en lydbølge relateret til dens målte værdi i decibalskala?
- Hvad er årsagen til rock erosion?
- Ikke-invasiv, etiketfri optisk metode visualiserer dybe, cellulær hjernesygdom in vivo
- En nettokraft på 100 N bevæger en masse med en acceleration 5 MS2. Hvad objektet?
- Er det sandt eller falsk, at afbalancerede kræfter på et objekt får den til at accelerere?


