Hvor mange gram chrom III -chlorid kræves for at producere 75,0 g sølvchlorid?
1. Skriv den afbalancerede kemiske ligning:
CRCL₃ (aq) + 3agno₃ (aq) → 3Agcl (s) + cr (no₃) ₃ (aq)
2. Bestem de molære masser af de relevante forbindelser:
* CRCL₃:158,36 g/mol
* AGCL:143,32 g/mol
3. Beregn molen for produceret AGCL:
* Mol AgCl =(Mass of AgCl) / (Molær masse af AGCL)
* Mol AgCl =75,0 g / 143,32 g / mol =0,523 mol
4. Brug molforholdet fra den afbalancerede ligning for at finde molen af CRCL₃ nødvendig:
* Fra den afbalancerede ligning producerer 1 mol CRCL₃ 3 mol AgCl.
* Mol Crcl₃ =(mol AgCl) / 3
* Mol Crcl₃ =0,523 mol / 3 =0,174 mol
5. Beregn den krævede masse af Crcl₃ krævet:
* Mass af crcl₃ =(mol Crcl₃) * (molmasse Crcl₃)
* Masse Crcl₃ =0,174 mol * 158,36 g/mol = 27,6 g
Derfor kræves 27,6 gram chrom III -chlorid for at producere 75,0 g sølvchlorid.
 Varme artikler
Varme artikler
-
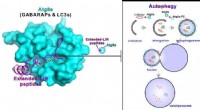 Forskere opdager autofagi-hæmmende peptider fra gigantiske ankyrinerDette visuelle abstrakt præsenterer de superstærke Atg8s-bindende peptider, der effektivt kan hæmme autofagi. Kredit:Division of Life Science, HKUST Autofagi, betyder selvspisning på græsk, er en
Forskere opdager autofagi-hæmmende peptider fra gigantiske ankyrinerDette visuelle abstrakt præsenterer de superstærke Atg8s-bindende peptider, der effektivt kan hæmme autofagi. Kredit:Division of Life Science, HKUST Autofagi, betyder selvspisning på græsk, er en -
 Ny metode inverterer selvsamling af flydende krystallerAktiveringen af en kopformet genstand (halv kugle), der langsomt foldes til en ellipsoide ved opvarmning og vender tilbage til kopform under afkøling. Dette objekt viser også at minimere dets overfl
Ny metode inverterer selvsamling af flydende krystallerAktiveringen af en kopformet genstand (halv kugle), der langsomt foldes til en ellipsoide ved opvarmning og vender tilbage til kopform under afkøling. Dette objekt viser også at minimere dets overfl -
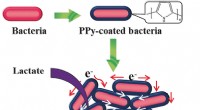 Ledende skal for bakterierKredit:Wiley Under anaerobe forhold, visse bakterier kan producere elektricitet. Denne adfærd kan udnyttes i mikrobielle brændselsceller, med særligt fokus på spildevandsbehandlingsordninger. Et s
Ledende skal for bakterierKredit:Wiley Under anaerobe forhold, visse bakterier kan producere elektricitet. Denne adfærd kan udnyttes i mikrobielle brændselsceller, med særligt fokus på spildevandsbehandlingsordninger. Et s -
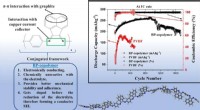 Nyt copolymerbindemiddel for at forlænge levetiden af lithium-ion-batterierNyt copolymerbindemiddel til grafitanode på Li-ion-batterier. BP-copolymeren byder på flere fordele, der sætter den milevidt foran det konventionelle PVDF-bindemiddel med hensyn til stabilitet og hold
Nyt copolymerbindemiddel for at forlænge levetiden af lithium-ion-batterierNyt copolymerbindemiddel til grafitanode på Li-ion-batterier. BP-copolymeren byder på flere fordele, der sætter den milevidt foran det konventionelle PVDF-bindemiddel med hensyn til stabilitet og hold
- Hvad er to andre navne på varmeenergi?
- Hvad er små organer, der udfører specifikke funktioner inde i cellen?
- Syrer og baser fundet i hjem
- Når et objekt falder med en konstant hastighed de to kræfter, der skal være ens i størrelse, men…
- Hvordan man finder, hvor mange mol der er i en forbindelse
- Hvad er gruppens placering af cadmium?


