Ethanol C2H5OH og methylether CH3OCH3 Har den samme molære masse.W Hich har et højere kogepunkt?
* Hydrogenbinding: Ethanol kan danne hydrogenbindinger på grund af tilstedeværelsen af -OH -gruppen. Hydrogenbindinger er stærke intermolekylære kræfter, der kræver en betydelig mængde energi for at bryde.
* dipol-dipolinteraktioner: Begge molekyler er polære, hvilket fører til dipol-dipol-interaktioner. Imidlertid er hydrogenbindinger stærkere end dipol-dipol-interaktioner.
* methylether: Methylether oplever kun svagere dipol-dipol-interaktioner og London-spredningskræfter.
Kortfattet: Ethanolens evne til at danne hydrogenbindinger, en stærkere intermolekylær kraft, resulterer i et højere kogepunkt sammenlignet med methylether.
Sidste artikelHvilken gas producerer sur regn på kalksten?
Næste artikelListe over nogle af de forbrændingsprodukter?
 Varme artikler
Varme artikler
-
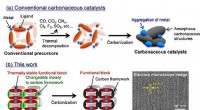 En ny synteserute for alternative katalysatorer af ædelmetallerSynteseskemaer af (a) konventionelle carbonholdige katalysatorer og (b) dette arbejde for ordnede carbonholdige rammer. Kredit:Hirotomo Nishihara Forskere har udviklet en ny synteserute for altern
En ny synteserute for alternative katalysatorer af ædelmetallerSynteseskemaer af (a) konventionelle carbonholdige katalysatorer og (b) dette arbejde for ordnede carbonholdige rammer. Kredit:Hirotomo Nishihara Forskere har udviklet en ny synteserute for altern -
 Verdens fineste guldprøve undersøgt med Los Alamos neutronerThe Rams Horn wire guldprøve. Kredit:Harvard University Ved at bruge neutronkarakteriseringsteknikker har et hold videnskabsmænd kigget ind i et af de mest unikke eksempler på trådguld, for første
Verdens fineste guldprøve undersøgt med Los Alamos neutronerThe Rams Horn wire guldprøve. Kredit:Harvard University Ved at bruge neutronkarakteriseringsteknikker har et hold videnskabsmænd kigget ind i et af de mest unikke eksempler på trådguld, for første -
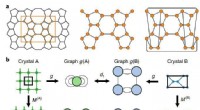 En ny matematisk tilgang til forståelse af zeolitterGraph og supercell matching. en, Repræsentation af en zeolit ved hjælp af en graf (til venstre). Enhedscellegrafen (midten) modificeres for at opfylde periodiske grænsebetingelser ved at sløjfe bind
En ny matematisk tilgang til forståelse af zeolitterGraph og supercell matching. en, Repræsentation af en zeolit ved hjælp af en graf (til venstre). Enhedscellegrafen (midten) modificeres for at opfylde periodiske grænsebetingelser ved at sløjfe bind -
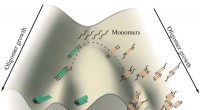 Tumbleweeds eller fibriller:Tau-proteiner skal vælgeEt skema viser væksten af tau-oligomerer impliceret i Alzheimers og Picks sygdomme. Monomerer af tau har tendens til at aggregere langs to kanaler, den ene fører til fibriller, der danner sammenfilt
Tumbleweeds eller fibriller:Tau-proteiner skal vælgeEt skema viser væksten af tau-oligomerer impliceret i Alzheimers og Picks sygdomme. Monomerer af tau har tendens til at aggregere langs to kanaler, den ene fører til fibriller, der danner sammenfilt
- Dampanalyse i realtid kan forbedre træning af hunde, der registrerer eksplosive stoffer
- Hvad påvirker metabolisk hastighed?
- Google Street View-biler er øjne på jorden for metanlækager i byerne
- Kvinder viser seksuel præference for høje, dominerende mænd – så er ulighed mellem kønnene uund…
- Hvilke molekyler er en hydrogenbinding ch3oh ch3cl ch3ooh hcl c4h8 ph3?
- Kan vi bringe harren tilbage til Michigan?


