Beskriv den generelle placering af elektroner i en kovalent binding?
Her er en mere detaljeret forklaring:
* atomiske orbitaler: Før limning bor elektroner i atomiske orbitaler omkring hvert atom.
* overlappende orbitaler: Under dannelse af kovalent binding overlapper atomiske orbitaler fra forskellige atomer. Denne overlapning skaber en ny, delt orbital, kaldet A molekylær orbital .
* Delt elektrondensitet: Elektronerne i den delte molekylære orbital er delokaliserede mellem de to atomer. De tilbringer tid omkring begge kerner og bidrager til den attraktive kraft, der holder atomerne sammen.
* bonding -region: Regionen af rummet, hvor elektrondensiteten er højest i den delte molekylære orbital kaldes bonding -regionen . Det er her, elektronerne mest sandsynligt findes, og hvor atomerne er stærkest tiltrukket af hinanden.
Derfor er den generelle placering af elektroner i en kovalent binding i området for rummet mellem de to bundne atomer, i binding af orbital.
 Varme artikler
Varme artikler
-
 Udnyttelse af reversibel opløselighed giver mulighed for direkte, optisk mønster af hidtil uset sm…Tynde film af halvledende polymerer blev fremstillet med en overflade-initieret vækst, resulterer i en unik molekylær organisation. Polymerkæder voksede fra overfladen og foldede derefter for at danne
Udnyttelse af reversibel opløselighed giver mulighed for direkte, optisk mønster af hidtil uset sm…Tynde film af halvledende polymerer blev fremstillet med en overflade-initieret vækst, resulterer i en unik molekylær organisation. Polymerkæder voksede fra overfladen og foldede derefter for at danne -
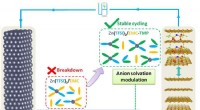 Solvation-omlægning bringer stabile zink/grafit-batterier tættere på kommerciel netlagerTuning af anionopløsningsnetværket af karbonatbaseret elektrolyt til højspændings Zn/grafitbatterier. Kredit:Zhao Jingwen Med vedvarende energi i netskala i stigning, mange forskere har flyttet de
Solvation-omlægning bringer stabile zink/grafit-batterier tættere på kommerciel netlagerTuning af anionopløsningsnetværket af karbonatbaseret elektrolyt til højspændings Zn/grafitbatterier. Kredit:Zhao Jingwen Med vedvarende energi i netskala i stigning, mange forskere har flyttet de -
 Forskergruppen afdækker tabte billeder fra det 19. århundredeEt daguerreotypibillede fra det 19. århundrede viser det svageste omrids af en kvinde, indtil billedet genoprettes gennem en ny proces, udviklet ved Western University og Canadian Light Source Inc, de
Forskergruppen afdækker tabte billeder fra det 19. århundredeEt daguerreotypibillede fra det 19. århundrede viser det svageste omrids af en kvinde, indtil billedet genoprettes gennem en ny proces, udviklet ved Western University og Canadian Light Source Inc, de -
 Cement, salt og vand:Et nyt lagermateriale til grøn varmeKredit:CC0 Public Domain Opvarmning af det rum, hvor vi bor eller arbejder, er en almindelig nødvendighed i de fleste beboede områder. Den energi, der kræves til denne proces, er ansvarlig for en
Cement, salt og vand:Et nyt lagermateriale til grøn varmeKredit:CC0 Public Domain Opvarmning af det rum, hvor vi bor eller arbejder, er en almindelig nødvendighed i de fleste beboede områder. Den energi, der kræves til denne proces, er ansvarlig for en


