Korroder kobber eller jern hurtigere, og hvorfor?
* Elektrokemiske reaktioner: Korrosion er en elektrokemisk proces. Metaller reagerer med deres miljø, mister elektroner og danner oxider. Denne proces er påvirket af faktorer som:
* Elektrokemisk potentiale: Jern har et mere negativt elektrokemisk potentiale end kobber. Det betyder, at det er mere sandsynligt, at det mister elektroner og korroderer.
* Tilstedeværelse af ilt og vand: Både jern og kobber korroderer i nærvær af ilt og vand. Imidlertid reagerer jern lettere med disse elementer.
* Dannelse af oxider:
* jernoxid (rust): Jern danner et løst, porøst oxidlag kaldet rust. Rust er ikke beskyttende og tillader yderligere korrosion at forekomme.
* Kobberoxid: Kobber danner et stramt, beskyttende oxidlag kaldet Patina. Patina fungerer som en barriere og bremser yderligere korrosion.
* Miljøfaktorer:
* surhed: Iron korroderer hurtigere i sure miljøer.
* saltholdighed: Saltvand fremskynder korrosion i både jern og kobber, men jern er mere modtageligt.
Kortfattet: Iron's lavere elektrokemiske potentiale, det porøse natur af dets oxidlag og dets større reaktivitet med ilt og vand bidrager alle til dets hurtigere korrosionshastighed sammenlignet med kobber.
 Varme artikler
Varme artikler
-
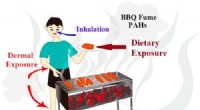 Hud ansvarlig for større eksponering for kræftfremkaldende stoffer i grillrøg end lungerKredit:American Chemical Society Med sommeren på vej, det er kun et spørgsmål om tid, før duften og smagen af grillmad dominerer nabolaget. Men der er en ulempe ved at grille, som bogstaveligt t
Hud ansvarlig for større eksponering for kræftfremkaldende stoffer i grillrøg end lungerKredit:American Chemical Society Med sommeren på vej, det er kun et spørgsmål om tid, før duften og smagen af grillmad dominerer nabolaget. Men der er en ulempe ved at grille, som bogstaveligt t -
 Plastic upcycling:Fra affald til brændstof for mindrePlastaffald kan en dag blive upcyclet til brugbare råvarekemikalier i stedet for at ende i miljøet. Kredit:Cortland Johnson, Pacific Northwest National Laboratory En plastgenbrugsinnovation, der gø
Plastic upcycling:Fra affald til brændstof for mindrePlastaffald kan en dag blive upcyclet til brugbare råvarekemikalier i stedet for at ende i miljøet. Kredit:Cortland Johnson, Pacific Northwest National Laboratory En plastgenbrugsinnovation, der gø -
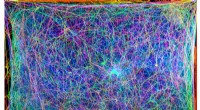 At lave musik fra edderkoppespindTværsnitsbilleder (vist i forskellige farver) af et edderkoppespind blev kombineret til dette 3D-billede og oversat til musik. Kredit:Isabelle Su og Markus Buehler Edderkopper er mesterbyggere, ek
At lave musik fra edderkoppespindTværsnitsbilleder (vist i forskellige farver) af et edderkoppespind blev kombineret til dette 3D-billede og oversat til musik. Kredit:Isabelle Su og Markus Buehler Edderkopper er mesterbyggere, ek -
 DNA-origami overskrider vigtige tærsklerI et første skridt danner forskere ved det tekniske universitet i München V-formede byggesten ved hjælp af DNA-origami-teknikker. Bestemt af åbningsvinklen samles et defineret antal byggesten selv i e
DNA-origami overskrider vigtige tærsklerI et første skridt danner forskere ved det tekniske universitet i München V-formede byggesten ved hjælp af DNA-origami-teknikker. Bestemt af åbningsvinklen samles et defineret antal byggesten selv i e
- Hvad er frekvensen af en foton, hvis bølgelængde er 6000
- Hvad er vinkelret på et plant spejl?
- Toadstools er moder naturers geologiske svampe
- Undersøgelse om Afrika syd for Sahara:Lavere chancer for individuel velstand i regioner langt fra k…
- Hvad er målingen af kraftgravet på et objekt?
- Vil du lette stresset ved nedskæringer? Hold billeder, mindeværdige ting, siger forskning


