Hvordan påvirker en forurening smeltepunktet for fast stof?
1. Sænkning af smeltepunktet:
* urenheder forstyrrer krystalgitteret: Rene faste stoffer har en meget ordnet krystalstruktur. Når der indføres en forurening, forstyrrer den denne rækkefølge. Dette gør det lettere for molekylerne at bryde fri fra deres positioner og overgang til en flydende tilstand og dermed sænke smeltepunktet.
* Dannelse af en eutektisk blanding: Nogle gange kan en forurening danne en eutektisk blanding med det faste stof. En eutektisk blanding har et lavere smeltepunkt end nogen af de rene komponenter. Dette forekommer, når forureningen interagerer med det faste stof på en måde, der svækker de intermolekylære kræfter, der holder det faste stof sammen.
2. Hævelse af smeltepunktet:
* dannelse af fast opløsning: I nogle tilfælde kan forureningen opløses i det faste stof for at danne en solid opløsning. Dette kan styrke krystalgitteret, hvilket gør det sværere at bryde fra hinanden og resultere i et højere smeltepunkt. Dette er mindre almindeligt end den sænkende effekt.
I hvilket omfang en forurenende påvirker smeltepunktet afhænger af flere faktorer:
* type forurening: Nogle forurenende stoffer har en større effekt end andre.
* Koncentration af forureningen: Jo højere koncentration af forureningen er, jo større er effekten på smeltepunktet.
* Naturen af det faste stof: Nogle faste stoffer er mere følsomme over for forurenende stoffer end andre.
Eksempel:
Salt (NaCl) er en almindelig forurening i is. Det forstyrrer krystalstrukturen af is og sænker smeltepunktet. Dette er grunden til, at salt bruges til at smelte is på veje om vinteren.
Generelt har forurenende stoffer en tendens til at sænke smeltepunktet for et fast stof. Der er dog nogle undtagelser, hvor smeltepunktet kan hæves.
 Varme artikler
Varme artikler
-
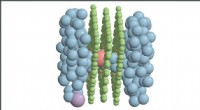 Supercomputere driver forskning i iontransportForskere bruger supercomputere til at hjælpe med at forstå den relativt sjældne hændelse, hvor salte i vand (blå) passerer gennem atom-tynde nanoporøse membraner. En tværgående chloridion (fersken) fr
Supercomputere driver forskning i iontransportForskere bruger supercomputere til at hjælpe med at forstå den relativt sjældne hændelse, hvor salte i vand (blå) passerer gennem atom-tynde nanoporøse membraner. En tværgående chloridion (fersken) fr -
 Autonomt voksende syntetiske DNA-strengePrimer Exchange Reaction (PER) kaskader muliggør autonom vækst af enkeltstrengede DNAer. På toppen, en katalytisk PER-hårnål binder en første primer (vist som en kort grå streng), udløser dens forlæng
Autonomt voksende syntetiske DNA-strengePrimer Exchange Reaction (PER) kaskader muliggør autonom vækst af enkeltstrengede DNAer. På toppen, en katalytisk PER-hårnål binder en første primer (vist som en kort grå streng), udløser dens forlæng -
 Overvindelse af udfordringerne med kontrolleret termisk aflejring af organiske diradikale stofferVenstre panel:Diradikalerne undersøgt i dette arbejde. Højre panel:Skitse af forskellige film (grøn farve) afsat på et underlag (grå farve). Kredit:Tuebingen Universitet Magnetisme er en egenskab
Overvindelse af udfordringerne med kontrolleret termisk aflejring af organiske diradikale stofferVenstre panel:Diradikalerne undersøgt i dette arbejde. Højre panel:Skitse af forskellige film (grøn farve) afsat på et underlag (grå farve). Kredit:Tuebingen Universitet Magnetisme er en egenskab -
 Forskere afslører strukturen af aminosyretransportør involveret i kræftForskere fra University of Groningen involveret i undersøgelsen - venstre til højre, stående:D.J. Slotboom, A. Guskov, A.A. Garaeva, C. Paulino - siddende:G.T. Oostergetel. Kredit:University of Gronin
Forskere afslører strukturen af aminosyretransportør involveret i kræftForskere fra University of Groningen involveret i undersøgelsen - venstre til højre, stående:D.J. Slotboom, A. Guskov, A.A. Garaeva, C. Paulino - siddende:G.T. Oostergetel. Kredit:University of Gronin
- Er mindre stjerner tættere på Jorden?
- En anden tilgang til online platforme er mulig:Samarbejde
- Hvilke to undersøgelsesområder giver de kerneoplysninger, der bruges til at klassificere organisme…
- Team udnytter spin af elektroner til at drive tech -enheder
- Hvad betyder skovområderne i Gradwitz var vid udstrækning og godt fyldt med vildt?
- 2020:Hvad skal der ske inden for teknologi – AirPods Pro, Oculus Quest vender tilbage til butikkerne


