Hvad er geometrien af dihydrogenmonosulfid?
Her er hvorfor:
* Centralatom: Svovl (er) er det centrale atom.
* Valenselektroner: Svovl har 6 valenselektroner, og hvert hydrogenatom har 1 valenselektron.
* binding: Svovl danner to enkeltbindinger med de to hydrogenatomer.
* Ensomme par: Svovl har to ensomme par elektroner.
* Elektronpar -frastødelse: De to ensomme par på svovl afviser bindingsparene, skubber hydrogenatomerne tættere sammen og skaber en bøjet form.
Obligationsvinklen i H₂s er cirka 92 ° , som er lidt mindre end den ideelle tetrahedrale vinkel på 109,5 ° på grund af den større frastødelse af de ensomme par.
Sidste artikelHvordan bestemmes retningen for en kemisk reaktion?
Næste artikelHvordan tester du brintgas?
 Varme artikler
Varme artikler
-
 Forskere udvikler nye metoder og smarte brøndboringsmaterialer til geotermisk boringSaleh og teamet udvikler nye smarte mistede cirkulationsmaterialer, der udvider sig inden for sprækkerne for at reducere ikke-boringstid og styrke brøndboringen i højtemperatur-boreoperationer. Kredit
Forskere udvikler nye metoder og smarte brøndboringsmaterialer til geotermisk boringSaleh og teamet udvikler nye smarte mistede cirkulationsmaterialer, der udvider sig inden for sprækkerne for at reducere ikke-boringstid og styrke brøndboringen i højtemperatur-boreoperationer. Kredit -
 Mobil enhed kan gøre det lettere at forudsige og kontrollere skadelige algeopblomstringerKredit:University of California, Los Angeles I de sidste 10 år har skadelige algeblomster - pludselige stigninger i bestanden af alger, typisk i kystområder og ferskvandssystemer - er blevet et
Mobil enhed kan gøre det lettere at forudsige og kontrollere skadelige algeopblomstringerKredit:University of California, Los Angeles I de sidste 10 år har skadelige algeblomster - pludselige stigninger i bestanden af alger, typisk i kystområder og ferskvandssystemer - er blevet et -
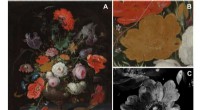 Kemisk og optisk billeddannelse forklarer, hvorfor en rose mistede sin farve i et berømt maleriPigmentnedbrydning i den gule rose i Abraham Mignons Stilleben med blomster og et ur. (A) Visuelt fotografi af stilleben med blomster og et ur af Abraham Mignon (1640-1679), olie på lærred, dateret ca
Kemisk og optisk billeddannelse forklarer, hvorfor en rose mistede sin farve i et berømt maleriPigmentnedbrydning i den gule rose i Abraham Mignons Stilleben med blomster og et ur. (A) Visuelt fotografi af stilleben med blomster og et ur af Abraham Mignon (1640-1679), olie på lærred, dateret ca -
 Enkeltcelleanalyse afslører heterogenitet i metaladsorptionKredit:LuckyStep/Shutterstock Biosorption er fjernelse af kontaminanter fra en prøve ved at adsorbere dem på overfladen af et biologisk materiale. Det forventes at give miljømæssige og økonomiske
Enkeltcelleanalyse afslører heterogenitet i metaladsorptionKredit:LuckyStep/Shutterstock Biosorption er fjernelse af kontaminanter fra en prøve ved at adsorbere dem på overfladen af et biologisk materiale. Det forventes at give miljømæssige og økonomiske
- Hvilken kraft kræves for at flytte en 6,0 kg bowlingkugle plus 2,0 meter per sekund kvadratisk?
- Skylden spil over 830-mn-euro forlig i VWs tyske diesel sager
- Hvilket ord betyder en pause i jordskorpe, hvor klipper kan glide forbi hinanden?
- Er de 5 kulstofsukker i DNA -nukleotider kaldet en ribose?
- Hvad er de faktorer, der påvirker en biodiversitet i området?
- Hvilket par består af en svag syre og en stærk base?


