Hvordan bestemmes retningen for en kemisk reaktion?
1. Termodynamik:
* entalpiændring (ΔH): Dette måler den varme, der er absorberet eller frigivet under reaktionen.
* eksotermiske reaktioner (ΔH <0): Slip varme og favorit produktdannelse ved lave temperaturer.
* endotermiske reaktioner (ΔH> 0): Absorbere varme og favorisere produktdannelse ved høje temperaturer.
* entropiændring (ΔS): Dette måler ændringen i lidelsen eller tilfældigheden af systemet.
* stigning i entropi (ΔS> 0): Favoriserer produktdannelse, især ved højere temperaturer.
* Gibbs Free Energy Change (ΔG): Dette kombinerer entalpi og entropiændringer for at bestemme spontaniteten af en reaktion.
* negativ ΔG: Reaktion er spontan (favoriserer produktdannelse).
* positiv ΔG: Reaktion er ikke-spontan (favoriserer reaktanter).
2. Kinetik:
* Aktiveringsenergi (EA): Dette er den minimale energi, der kræves for at reaktanter skal overvinde energibarrieren og danne produkter.
* Nedre aktiveringsenergi: Hurtigere reaktionshastighed, uanset om reaktionen er spontan eller ej.
* reaktionsmekanisme: Sekvensen af trin involveret i reaktionen. Visse trin kan være hurtigere eller langsommere end andre, hvilket påvirker den samlede reaktionshastighed.
3. Ligevægt:
* ligevægtskonstant (K): Dette forhold mellem produkter og reaktanter i ligevægt.
* k> 1: Ligevægt favoriserer produkter.
* k <1: Ligevægt favoriserer reaktanter.
4. Le Chateliers princip:
Dette princip siger, at hvis der anvendes en ændring af betingelsen på et system i ligevægt, vil systemet skifte i en retning, der lindrer stresset. Betingelser, der kan ændres, inkluderer:
* Temperatur: Stigende temperatur favoriserer den endotermiske retning.
* tryk: Stigende tryk favoriserer siden med færre mol gas.
* Koncentration: Tilføjelse af reaktanter eller fjernelse af produkter skifter ligevægten mod produktsiden, mens fjernelse af reaktanter eller tilsætning af produkter skifter det mod reaktantsiden.
Kortfattet:
Retningen af en kemisk reaktion bestemmes af samspillet mellem termodynamiske, kinetiske og ligevægtsfaktorer. Ved at forstå disse faktorer kan vi forudsige retningen for en reaktion og manipulere betingelser for at favorisere dannelsen af ønskede produkter.
Sidste artikelHvad er den kemiske formel for tri svovl pentoxid?
Næste artikelHvad er geometrien af dihydrogenmonosulfid?
 Varme artikler
Varme artikler
-
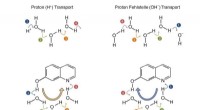 Frem eller tilbage? Nye veje for protoner i vand eller methanolKredit:FV Berlin En kollaborativ ultrahurtig spektroskopi og ab initio molekylær dynamik simuleringsundersøgelse viser, at ledige protoner i form af hydroxid/methoxidioner er lige så relevante for
Frem eller tilbage? Nye veje for protoner i vand eller methanolKredit:FV Berlin En kollaborativ ultrahurtig spektroskopi og ab initio molekylær dynamik simuleringsundersøgelse viser, at ledige protoner i form af hydroxid/methoxidioner er lige så relevante for -
 Ny chip måler flere cellulære reaktioner for at fremskynde opdagelse af lægemidlerCMOS multimodal cellulær interface array chip i drift i et standard biologilaboratorium. Kredit:Georgia Institute of Technology At finde måder at forbedre lægemiddeludviklingsprocessen – som i øje
Ny chip måler flere cellulære reaktioner for at fremskynde opdagelse af lægemidlerCMOS multimodal cellulær interface array chip i drift i et standard biologilaboratorium. Kredit:Georgia Institute of Technology At finde måder at forbedre lægemiddeludviklingsprocessen – som i øje -
 Afdækning af hemmelighederne bag materialenedbrydning i et lithium-ion-batteriSkematisk diagram af KIST batterianalyseplatform. Kredit:Korea Institute of Science and Technology (KIST) Midt i den globale indsats for CO2-neutralitet er bilproducenter over hele verden aktivt en
Afdækning af hemmelighederne bag materialenedbrydning i et lithium-ion-batteriSkematisk diagram af KIST batterianalyseplatform. Kredit:Korea Institute of Science and Technology (KIST) Midt i den globale indsats for CO2-neutralitet er bilproducenter over hele verden aktivt en -
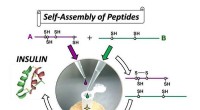 Højeffektiv syntese af insulin ved selvsamling baseret organisk kemiEn simpel protokol udviklet til insulinpræparation. Kredit:Michio Iwaoka Forskere ved Tokai, Osaka, Tohoku og Fukuoka Universiteter rapporterer i tidsskriftet Kommunikationskemi på syntese af in
Højeffektiv syntese af insulin ved selvsamling baseret organisk kemiEn simpel protokol udviklet til insulinpræparation. Kredit:Michio Iwaoka Forskere ved Tokai, Osaka, Tohoku og Fukuoka Universiteter rapporterer i tidsskriftet Kommunikationskemi på syntese af in
- Astronomer opdager to nye polarer
- Forskere bruger naturens designprincipper til at skabe specialiserede nanostoffer
- Hvad er funktionen af kraft og bevægelse?
- Hvad de velhavende betragter som 'rimeligt' er måske ikke lig med andre
- Anbefaling til kryptografisk nøglegenerering
- Hvilke forbindelser indeholder kulstofelement?


