Hvad sker der, når der tilsættes vand til vandfri kobber II -sulfat?
cuso 4 (S) + 5H 2 O (L) → CUSO 4 · 5H 2 O (S)
Her er en sammenbrud af, hvad der sker:
* vandfri kobber (II) sulfat (CUSO 4 ) er et hvidt pulver. Det mangler vandmolekyler, der er fastgjort til det.
* vand (H 2 O) fungerer som reaktant, hvilket giver de vandmolekyler, der er nødvendige for reaktionen.
* kobber (II) sulfatpentahydrat (cuso 4 · 5H 2 O) er dannet. Dette er et blåt krystallinsk fast stof. Vandmolekylerne er nu inkorporeret i krystalstrukturen og danner en hydreret forbindelse.
Farveændringen:
Farveændringen fra hvid til blå skyldes dannelsen af det hydratiserede kobber (II) sulfat. Vandmolekylerne interagerer med kobber (II) -ionerne og ændrer den måde, de absorberer og reflekterer lys på. Den blå farve er et resultat af denne interaktion.
Andre observationer:
* Reaktionen er eksoterm, hvilket betyder, at den frigiver varme. Du føler måske containeren opvarmes lidt.
* Reaktionen er reversibel. Hvis du opvarmer det blå kobber (II) sulfatpentahydrat, kan du køre vandmolekylerne af og vende det tilbage til den hvide vandfri form.
Kortfattet:
Tilsætning af vand til vandfri kobber (II) sulfat resulterer i en kemisk reaktion, hvor vandmolekylerne inkorporeres i kobber (II) sulfatkrystallstrukturen, hvilket danner det blå hydratiserede kobber (II) sulfatpentahydrat. Denne reaktion ledsages af en mærkbar farveændring og en frigivelse af varme.
 Varme artikler
Varme artikler
-
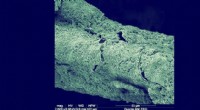 Lyser vejen til genbrug af kuldioxidSEM -billede viser den tætte og ensartede katodiske biofilm, som hovedsageligt omfatter kemolithoautotrofer, og kunne tjene som biokatalysatorer til effektiv carbondioxidomdannelse til acetat. Kredit:
Lyser vejen til genbrug af kuldioxidSEM -billede viser den tætte og ensartede katodiske biofilm, som hovedsageligt omfatter kemolithoautotrofer, og kunne tjene som biokatalysatorer til effektiv carbondioxidomdannelse til acetat. Kredit: -
 Syntetiske biologer hacker bakteriesensorerFor at opdage funktionen af et helt nyt to-komponent system, Rice Universitys syntetiske biologer omkoblede det genetiske kredsløb i syv bakteriestammer og undersøgte, hvordan hver enkelt opførte si
Syntetiske biologer hacker bakteriesensorerFor at opdage funktionen af et helt nyt to-komponent system, Rice Universitys syntetiske biologer omkoblede det genetiske kredsløb i syv bakteriestammer og undersøgte, hvordan hver enkelt opførte si -
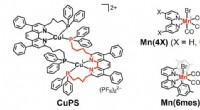 Store fremskridt for kulstoffangst ved hjælp af jordrige elementer som fotokatalytisk systemStrukturen af CuPS, kobberkomplekset, der opfører sig som en redox -lysfølsomhed, og den manganbaserede katalysator udviklet i undersøgelsen. Kredit: Journal of the American Chemical Society Fo
Store fremskridt for kulstoffangst ved hjælp af jordrige elementer som fotokatalytisk systemStrukturen af CuPS, kobberkomplekset, der opfører sig som en redox -lysfølsomhed, og den manganbaserede katalysator udviklet i undersøgelsen. Kredit: Journal of the American Chemical Society Fo -
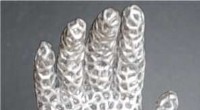 Forskning i flydende metal påberåber Terminator -film - men meget venligereEn hånd, der langsomt åbner sig, når metalgitteret smelter. Kredit:Pu Zhang Pu Zhang kan lide at sammenligne sit teams forskning om flydende metaller med Terminator - specifikt 1991s Terminator 2:
Forskning i flydende metal påberåber Terminator -film - men meget venligereEn hånd, der langsomt åbner sig, når metalgitteret smelter. Kredit:Pu Zhang Pu Zhang kan lide at sammenligne sit teams forskning om flydende metaller med Terminator - specifikt 1991s Terminator 2:
- Har solenergi en indflydelse på jorden?
- Øget organisatorisk støtte til medarbejdernes adoptionsindsats giver positive fordele
- Vinpolyfenoler kan afværge bakterier, der forårsager huller og tandkødssygdomme
- Leonardo-showet åbner i Firenze, Italien
- Hvad ville være en af de første mineraler, der krystalliserer fra flydende sten i en mafisk stø…
- Kraft, der modstår bevægelsen af en håndtag?


