Hvad reagerer platin med?
reaktioner Platinum er kendt for:
* halogener (fluor, klor, brom, iod): Platin reagerer med halogener ved høje temperaturer for at danne platinhalogenider.
* Aqua Regia: Dette er en meget ætsende blanding af koncentreret salpetersyre og saltsyre, kendt for at opløse både guld og platin.
* cyanid: Platinum reagerer med cyanidioner for at danne komplekse ioner.
* ilt: Ved høje temperaturer kan platin reagere med ilt for at danne platinoxid (PTO2).
* Visse metaller: Platin kan danne legeringer med andre metaller, herunder guld, kobber og iridium.
forhold, der påvirker platinreaktivitet:
* Temperatur: Højere temperaturer øger sandsynligheden for, at platin reagerer.
* tilstedeværelse af katalysatorer: Visse katalysatorer kan fremskynde reaktionshastigheden.
* overfladeareal: Et større overfladeareal af platin øger dens reaktivitet.
Vigtig note: Platinum betragtes som resistente over for mest almindelige syrer, men det kan opløses af stærke oxidationsmidler som Aqua Regia.
Anvendelser af Platinums reaktivitet:
* katalyse: Platinums reaktivitet gør det til en værdifuld katalysator i forskellige kemiske processer.
* smykker: Platinums modstand mod plettering og korrosion gør det populært for smykker.
* Industrielle anvendelser: Platinum bruges i forskellige brancher, herunder Automotive, Electronics og Aerospace Industries.
Generelt er Platinums reaktivitet begrænset, men betydelig i specifikke applikationer. Det er kendt for sin høje modstand mod korrosion og dens evne til at danne legeringer og komplekser.
 Varme artikler
Varme artikler
-
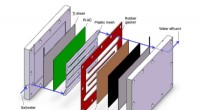 Ingeniører udvikler teknologi til at trække specifikke forurenende stoffer fra drikke- og spildeva…Rice Universitys nye platformsteknologi kan selektivt filtrere forurenende stoffer fra spildevand, drikkevand og industrivæsker. I test, en konstrueret belægning af harpiks, polymer og aktivt kul fjer
Ingeniører udvikler teknologi til at trække specifikke forurenende stoffer fra drikke- og spildeva…Rice Universitys nye platformsteknologi kan selektivt filtrere forurenende stoffer fra spildevand, drikkevand og industrivæsker. I test, en konstrueret belægning af harpiks, polymer og aktivt kul fjer -
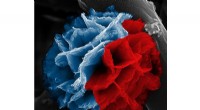 Fremstilling af rustne polymerer til energilagringDette farvede billede viser en poly (3, 4-ethylendioxythiophen) (PEDOT) nanoflower syntetiseret via hydrolyseassisteret dampfasepolymerisation ved hjælp af ethanol som opløsningsmiddel. Den blå farve
Fremstilling af rustne polymerer til energilagringDette farvede billede viser en poly (3, 4-ethylendioxythiophen) (PEDOT) nanoflower syntetiseret via hydrolyseassisteret dampfasepolymerisation ved hjælp af ethanol som opløsningsmiddel. Den blå farve -
 Nye katalysatorer efterligner menneskesynLilla LEDer aktiverer denne nye katalysator designet hos ICIQ. Kredit:Public domain Fotoreceptorer hos hvirveldyr består typisk af to separate farveløse dele:et organisk pigment og et protein. Kom
Nye katalysatorer efterligner menneskesynLilla LEDer aktiverer denne nye katalysator designet hos ICIQ. Kredit:Public domain Fotoreceptorer hos hvirveldyr består typisk af to separate farveløse dele:et organisk pigment og et protein. Kom -
 Video:Sådan fungerer airbagsKredit:The American Chemical Scoiety Normalt, noget, der blæser op i dit ansigt, er slemt. Men i tilfælde af en bilulykke, og i forbindelse med en sikkerhedssele, en bestemt eksplosion kan meget v
Video:Sådan fungerer airbagsKredit:The American Chemical Scoiety Normalt, noget, der blæser op i dit ansigt, er slemt. Men i tilfælde af en bilulykke, og i forbindelse med en sikkerhedssele, en bestemt eksplosion kan meget v
- Hvilke mineraler krystalliserer tidligt i reaktionsserien?
- Hvad sker der, når en bølge rejser fra et medium til et andet i brydning?
- Hvordan er udtrykkene molmasse og atomisk samme?
- Ny forskning finder dyb evolutionær oprindelse af et unikt pattedyrs anatomiske mønster
- Hvorfor udsender solen det meste af sin energi i form synligt lys?
- Mobiltelefondata kombineret med spildevandstest viser stofbrugsmønstre


