Hvordan er udtrykkene molmasse og atomisk samme?
atommasse:
* Henviser til massen af et enkelt atom af et element.
* Målt i atommasseenheder (AMU).
* Repræsenterer den gennemsnitlige masse af alle isotoper af dette element under hensyntagen til deres relative overflod.
molmasse:
* Henviser til massen af en mol af et stof (element eller forbindelse).
* Målt i gram pr. Mol (g/mol).
* Numerisk ækvivalent med elementets atommasse, men med enhederne ændret til gram pr. Mol.
forhold:
Den vigtigste forbindelse er, at den numeriske værdi af et elements atommasse er den samme som den numeriske værdi af dens molære masse.
* For eksempel er atommassen af kulstof 12,01 amu, og dens molære masse er 12,01 g/mol.
Nøgleforskel:
Den vigtigste forskel er måleenheden . Atommasse måles i AMU, som er en meget lille enhed, mens molmasse måles i gram pr. Mol, hvilket er en mere praktisk enhed til daglig brug.
Kortfattet:
* Atommasse er massen af et enkelt atom.
* Molmasse er massen af en mol af et stof.
* Begge har den samme numeriske værdi, men forskellige enheder.
Sidste artikelHvordan ændrer du koncentrationen af et stof?
Næste artikelEr alle partiklerne i samme element forskellige?
 Varme artikler
Varme artikler
-
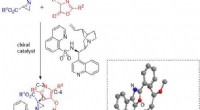 Asymmetrisk syntese af aziridin med en ny katalysator kan hjælpe med at udvikle nye lægemidlerFremstilling af aziridiner med højt udbytte og høj renhed ved hjælp af ny katalysator. Forskere fra Japan foreslog for nylig en mulig overgangstilstand for reaktionen mellem aziridiner og oxazoloner i
Asymmetrisk syntese af aziridin med en ny katalysator kan hjælpe med at udvikle nye lægemidlerFremstilling af aziridiner med højt udbytte og høj renhed ved hjælp af ny katalysator. Forskere fra Japan foreslog for nylig en mulig overgangstilstand for reaktionen mellem aziridiner og oxazoloner i -
 Når HIV-medicin ikke samarbejderHIV inficerer en menneskelig celle. Kredit:NIH Udtrykket synergi har fået et ry som et overbrugt buzzword, men det har en kvantificerbar definition i farmakologi. To lægemidler anses for synergist
Når HIV-medicin ikke samarbejderHIV inficerer en menneskelig celle. Kredit:NIH Udtrykket synergi har fået et ry som et overbrugt buzzword, men det har en kvantificerbar definition i farmakologi. To lægemidler anses for synergist -
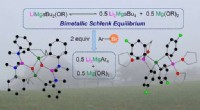 Lithium-magnesiumalkyl-alkoxy-mellemprodukter i Br-Mg-udvekslingKredit:Wiley Organometalliske reagenser er essentielle værktøjer i syntetisk kemi. De virker endnu bedre og mere effektivt i kombination med alkalialkoxider. Den nøjagtige karakter af denne effekt
Lithium-magnesiumalkyl-alkoxy-mellemprodukter i Br-Mg-udvekslingKredit:Wiley Organometalliske reagenser er essentielle værktøjer i syntetisk kemi. De virker endnu bedre og mere effektivt i kombination med alkalialkoxider. Den nøjagtige karakter af denne effekt -
 Billig vedvarende energi:Knækker den fotosynteseproces, der gør det muligt for planter at spalte v…Hvis mennesker kunne spalte vand ved hjælp af billige materialer som naturen gjorde, samfundet ville have en endeløs forsyning af billigt brintbrændstof til transport, uden kulstofemissioner. Kredit:J
Billig vedvarende energi:Knækker den fotosynteseproces, der gør det muligt for planter at spalte v…Hvis mennesker kunne spalte vand ved hjælp af billige materialer som naturen gjorde, samfundet ville have en endeløs forsyning af billigt brintbrændstof til transport, uden kulstofemissioner. Kredit:J
- Kinas EarthLab begynder forsøg som landets første anlæg, der udforsker jordsystemets interaktione…
- Gecko-inspirerede klæbemidler hjælper bløde robotfingre med at få et bedre greb
- Coronavirus-udbrud rejser spørgsmålet:Hvorfor er flagermusvirus så dødbringende?
- Neandertalere og moderne mennesker adskilte sig mindst 800, 000 år siden
- Hvad er generel definition af en bølge?
- Det mærkeligste sammenfald i fysik:AdS/CFT-korrespondancen


