En kolbe vejes og har en masse på 50,0 gram derefter 2,0 natriummetal tilsat til klorgas, der pumpes ind i dette, tillader reaktion fuldstændigt med C?
forståelse af reaktionen
Natrium (NA) reagerer kraftigt med chlorgas (CL₂) for at danne natriumchlorid (NaCl), et almindeligt bordsalt. Den afbalancerede kemiske ligning er:
2 Na + Cl₂ → 2 NaCl
Problemet
Problemet siger, at:
* En kolbe vejer 50,0 gram.
* 2,0 gram natrium (NA) tilsættes.
* Klorgas (CL₂) pumpes ind for at reagere fuldstændigt med natriumet.
hvad vi har brug for at finde
Problemet beder ikke eksplicit om en bestemt værdi, så vi antager, at vi ønsker at finde følgende:
1. Massen af natriumchlorid (NaCl) dannet.
2. den samlede masse af kolben og dens indhold efter reaktionen.
Beregninger
1. mol natrium:
- Den molære masse af natrium (NA) er 22,99 g/mol.
- mol Na =(2,0 g) / (22,99 g / mol) =0,087 mol
2. mol natriumchlorid:
- Fra den afbalancerede ligning reagerer 2 mol Na på form 2 mol NaCl. Så molen af NaCl dannet er lig med molen af Na:0,087 mol.
3. Mass af natriumchlorid:
- Den molære masse af NaCI er 58,44 g/mol.
- Masse NaCl =(0,087 mol) * (58,44 g/mol) =5,1 g
4. Total masse efter reaktion:
- Indledende masse kolbe =50,0 g
- Massen af natrium tilsat =2,0 g
- Masse NaCl dannet =5,1 g
- Samlet masse =50,0 g + 2,0 g + 5,1 g =57,1 g
Svar
* Massen af natriumchlorid (NaCl) dannet er 5,1 gram .
* Den samlede masse af kolben og dens indhold efter reaktionen er 57,1 gram .
Sidste artikelHvordan ved du, at svovl og kulstof danner en kovalent binding?
Næste artikelHvad er større et fluoratom eller kloratom?
 Varme artikler
Varme artikler
-
 Gør det muligt at oprette større 3D-trykte objekter med keramikSteyn Westbeek. Kredit:Eindhoven University of Technology Keramik er nogle af de ældste materialer fremstillet af mennesker. På samme tid, de er nogle af de mest lovende materialer til nøgleteknol
Gør det muligt at oprette større 3D-trykte objekter med keramikSteyn Westbeek. Kredit:Eindhoven University of Technology Keramik er nogle af de ældste materialer fremstillet af mennesker. På samme tid, de er nogle af de mest lovende materialer til nøgleteknol -
 Forskere håber på en ny ionfælde, der kan skabe verdens mest nøjagtige massespektrometerSkoltech-forskere har håb om en ny ionfælde for at skabe verdens mest nøjagtige massespektrometer. Kredit:Skoltech Massespektrometre bruges i vid udstrækning til at analysere meget komplekse kemis
Forskere håber på en ny ionfælde, der kan skabe verdens mest nøjagtige massespektrometerSkoltech-forskere har håb om en ny ionfælde for at skabe verdens mest nøjagtige massespektrometer. Kredit:Skoltech Massespektrometre bruges i vid udstrækning til at analysere meget komplekse kemis -
 Behøvede det tidlige liv lang tid, komplekse molekyler til at lave cellelignende rum?Membranløse rum lavet af korte polymerer (10 enheder lang polymer af asparaginsyre og 10 enheder lang lysin). Lysfeltbillede (venstre) og fluorescerende billede (højre), der viser fluorescerende mærke
Behøvede det tidlige liv lang tid, komplekse molekyler til at lave cellelignende rum?Membranløse rum lavet af korte polymerer (10 enheder lang polymer af asparaginsyre og 10 enheder lang lysin). Lysfeltbillede (venstre) og fluorescerende billede (højre), der viser fluorescerende mærke -
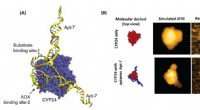 Lovende anticancer-molekyle identificeretFigur 1. En integreret tilgang til HS-AFM og molekylær docking for at afsløre bindingsmekanismen for Apt-7 til CYP24 (A) Den tredimensionelle visning af de toprangerede dockede konformationer af CYP24
Lovende anticancer-molekyle identificeretFigur 1. En integreret tilgang til HS-AFM og molekylær docking for at afsløre bindingsmekanismen for Apt-7 til CYP24 (A) Den tredimensionelle visning af de toprangerede dockede konformationer af CYP24
- BMW -overskuddet falder i flygtige tider
- Indfødte australske børn i pleje uden for hjemmet bor hovedsageligt hos familie eller indfødte pl…
- Indonesisk selfie-snapping-abe kåret til årets person
- Hvordan er en enkeltbinding repræsenteret i tegnet struktur?
- Hvilken opbremsning? Kinesiske shoppere satte ny Singles Day -udgiftsrekord
- Hvad er jordlandskabet?


