Hvordan ændrer du kulmonooxid til en nyttig gas?
1. Vandgasskiftreaktionen:
* Denne proces bruges ofte i industrien til at producere brintgas (H₂), som er et værdifuldt brændstof- og kemisk råmateriale.
* CO reagerer med damp (H₂O) i nærvær af en katalysator, typisk jernoxid eller kobberoxid:
CO + H₂O ⇌ CO₂ + H₂
* Denne reaktion er reversibel, og ligevægten favoriserer CO₂ og H₂ -produktion ved lavere temperaturer.
2. Methanation:
* Denne reaktion konverterer CO til metan (CH₄), en anden vigtig brændstofkilde.
* Reaktionen kræver en katalysator, typisk nikkel og forhøjede temperaturer og tryk:
CO + 3H₂ ⇌ CH₄ + H₂O
3. Fischer-Tropsch Synthesis:
* Denne proces bruger CO og H₂ til at producere en række kulbrinter, herunder benzin, diesel og parafin.
* Reaktionen kræver en katalysator, typisk jern, kobolt eller ruthenium og højt tryk og temperaturer.
4. Oxidation til kuldioxid:
* Selvom det ikke er teknisk at konvertere CO til en "nyttig" gas, fjerner oxidation for at co₂ den giftige karakter af CO.
* Denne proces bruges i katalytiske omformere i køretøjer til at konvertere CO -emissioner til mindre skadelige co₂.
Vigtige overvejelser:
* sikkerhed: Kulmonoxid er meget giftigt, så al håndtering og reaktioner skal udføres under strenge sikkerhedsprotokoller.
* katalysatorer: Den specifikke katalysator, der anvendes i hver proces, påvirker signifikant reaktionseffektivitet og produktselektivitet.
* reaktionsbetingelser: Temperatur, tryk og tilførselsgas sammensætning er afgørende faktorer, der påvirker resultatet af disse reaktioner.
Det er vigtigt at bemærke, at disse processer ofte involverer komplekse kemiske tekniske udfordringer og typisk udføres i en industriel skala.
Sidste artikelHvor mange iltatomer er der i 2al2o3?
Næste artikelHvad er symbolets oprindelse for svovl?
 Varme artikler
Varme artikler
-
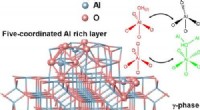 Karten af fem-koordineret aluminium på γ-Al2O3 overfladeGrafisk abstrakt. Kredit:ACS Central Science (2022). DOI:10.1021/acscentsci.1c01497 y-Al2 O3 , en vigtig katalysator og katalysatorbærer, er meget udbredt i forskellige industrielle anvendelser. De
Karten af fem-koordineret aluminium på γ-Al2O3 overfladeGrafisk abstrakt. Kredit:ACS Central Science (2022). DOI:10.1021/acscentsci.1c01497 y-Al2 O3 , en vigtig katalysator og katalysatorbærer, er meget udbredt i forskellige industrielle anvendelser. De -
 Maling af det molekylære lærred i superopløsningHoldet demonstrerede funktionerne i Action-PAINT på syntetiske DNA-nanostrukturer, der afslører identiske nærliggende dockingsteder for imager-strenge. I et første trin blev dockingstederne visualiser
Maling af det molekylære lærred i superopløsningHoldet demonstrerede funktionerne i Action-PAINT på syntetiske DNA-nanostrukturer, der afslører identiske nærliggende dockingsteder for imager-strenge. I et første trin blev dockingstederne visualiser -
 Hurtig test til diagnosticering af astmaDet holografiske mikroskop muliggør automatisk, tredimensionel sporing af immunceller i realtid. Kredit:Fraunhofer-Gesellschaft Astma er en af de mest almindelige luftvejssygdomme i verden, påvi
Hurtig test til diagnosticering af astmaDet holografiske mikroskop muliggør automatisk, tredimensionel sporing af immunceller i realtid. Kredit:Fraunhofer-Gesellschaft Astma er en af de mest almindelige luftvejssygdomme i verden, påvi -
 Fluorescerende molekyle forråder nedbrydningen af polymermaterialerH-DAAN kunne fungere som en radikal scavenger for polymere mekanoradikaler i bulk og generere DAAN•, som potentielt kunne evalueres ved EPR-spektroskopi og fluorescensmålinger på grund af deres høje s
Fluorescerende molekyle forråder nedbrydningen af polymermaterialerH-DAAN kunne fungere som en radikal scavenger for polymere mekanoradikaler i bulk og generere DAAN•, som potentielt kunne evalueres ved EPR-spektroskopi og fluorescensmålinger på grund af deres høje s
- Hvor mange atomer er der i calciumacetat?
- Hvorfor er der et lille hul i en vandpumpe?
- Hvad er 4 elementer, der bruger kinetisk energi?
- Ny metode gør det muligt at måle og selvjustere solid state-belysning baseret på forhold
- Det Indiske Ocean ø Mayotte løfter cyklonen rød alarm
- Hvordan shopping vil se ud i fremtiden


