Maling af det molekylære lærred i superopløsning

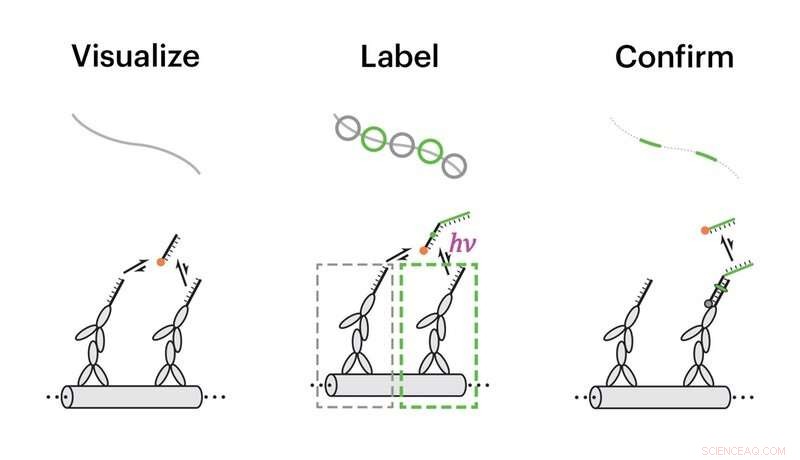
Holdet demonstrerede funktionerne i Action-PAINT på syntetiske DNA-nanostrukturer, der afslører identiske nærliggende dockingsteder for imager-strenge. I et første trin blev dockingstederne visualiseret ved superopløsningsmikroskopi (venstre), derefter, ved hjælp af en speciel softwarepakke, manuelt udvalgte individuelle dockingsteder blev mærket ved at tværbinde billedkamerastrengene til dem med UV-stråling (midten), og endelig, vellykkede mærkningsbegivenheder blev verificeret ved en ekstra runde superopløsningsmikroskopi (højre). Kredit:Wyss Institute ved Harvard University
For at forstå, hvordan individuelle molekyler spiller deres roller i biologiske processer inde i de celler, de syntetiseres i, forskere har udviklet super-resolution mikroskopi metoder til at visualisere dem på enkelt-molekyle niveau. Imidlertid, at undersøge deres funktioner, ultimativt, de vil også gerne være i stand til at ændre dem individuelt ved denne høje opløsning. Mens visualiseringen af enkelte molekyler har gjort store fremskridt i de senere år, indtil videre har det været udfordrende at ændre dem direkte i en kontrolleret, molekyle-til-molekyle måde.
Nu, rapporteret i Naturkemi , forskere ved Harvard's Wyss Institute for Biologically Inspired Engineering og Harvard Medical School (HMS), har udviklet "Action-PAINT, " en metode, der kombinerer holdets real-time DNA-PAINT super-opløsning mikroskopi tilgang med en enkelt-molekyle mærkningsstrategi på et ønsket sted inden for syntetiske nanostrukturer eller intakte celler. Denne tilgang kunne videreudvikles for at give forskere mulighed for at stimulere eller hæmme individuelle molekylers funktioner og studere konsekvenserne for normale biologiske og sygdomsrelaterede processer i realtid og superopløsning.
"Super-opløsning billeddannelsesmetoder har gjort det muligt for os at 'se det tidligere usynlige." Ved at koble vores DNA-PAINT superopløsningsmikroskopimetode med en tværbindingstilgang, vi kan nu også 'røre det tidligere utilgængelige' ved at fastgøre et fysisk håndtag til individuelt observerbare molekyler lige på tidspunktet for visualisering, " sagde Wyss Institute Core Faculty-medlem Peng Yin, Ph.D., der ledede undersøgelsen. Yin er også medleder af instituttets Molecular Robotics Initiative, og professor i systembiologi ved HMS.
Yins team udviklede en to-trins tilgang, der først visualiserer enkelte proteiner eller andre molekyler i super opløsning, og overfører derefter et molekylært mærke til det ønskede målsted. Eventuelt forskerne kan bekræfte vellykkede overførsler med en ekstra runde af superopløsningsbilleddannelse.
Det første trin af enkelt-molekyle billeddannelse er afhængig af DNA-PAINT-metoden, der gjorde det muligt for teamet først at bestemme den præcise lokalisering af molekyler eller molekylære træk, der er rumligt adskilt af afstande langt under lysets diffraktionsgrænse, og derfor usynlig for de fleste mikroskoper. Forskerne knyttede først en kort "dockingstreng" af DNA til målet, der tjener som et bindingssted for en komplementær "imagerstreng", der bærer et fluorescerende farvestof. Fordi imager-strengen binder med en programmerbar on-off-hastighed, det producerer definerede "blinkende" hændelser, som kan observeres ved hjælp af standardmikroskoper. For at vedhæfte en fysisk etiket til målet, forskerne udførte deres første superopløsningsbilleddannelsestrin med en lidt mere kompleks billedstreng, der også inkluderede en foto-inducerbar tværlinker, som er i stand til kemisk at forbinde docking og imager-streng til hinanden, når de udsættes for UV-stråling, og en yderligere reportersekvens.
At mærke individuelle proteinmål i intakte celler med Action-PAINT, docking-strenge er knyttet til antistofmolekyler, der binder sig til målproteiner med høj specificitet. Alle antistofbindingshændelser ved målproteiner i et defineret område visualiseres med komplementære fluorescerende billedstrenge ved hjælp af superopløsningsmikroskopi (venstre), og målproteiner i håndplukkede områder vist som grønne firkanter (midten) er mærket ved tværbindingshændelser. Endelig, vellykkede tværbindingshændelser bekræftes ved at bruge sekundære billedbehandlingsstrenge og billeddannelse i superopløsning (højre). Kredit:Wyss Institute ved Harvard University
"En kritisk komponent i vores nye metode er den præcise kontrol af tværbindingslaseren, som fungerer synkront med den superopløselige blinksekvens. Dette konverterer virkelig vores DNA-PAINT superopløsningsmikroskopi fra en passiv billeddannelsesmetode til en aktiv, muliggør interaktion i realtid mellem forskeren og individuelle molekylære mål, " sagde co-first og co-korresponderende forfatter Mingjie Dai.
For at aktivere denne nye funktion, holdet udviklede en softwarepakke, der gjorde det muligt for dem først at kortlægge de præcise placeringer af alle molekylære mål i et område af interesse ved hjælp af DNA-PAINT-metoden, og derefter stramt synkronisere blinken af en UV med efterfølgende blinkende hændelser. "På denne måde kunne vi kemisk binde imager-strengen til specialudvalgte molekylære mål, en efter en, med molekylær opløsning - som en maler lægger sin farve ned, patch for patch i pointillisme stil, " sagde Dai, Ph.D., en tidligere postdoc-stipendiat på Yins hold, som i øjeblikket er afdelingsstipendiat ved HMS's afdeling for systembiologi og teknologiudviklingsstipendiat ved Wyss Institute.
For at demonstrere effektiviteten og selektiviteten af deres tilgang, holdet brugte først syntetiske DNA-nanostrukturer, der afslørede dockingsteder for imager-strenge i definerede mønstre. "At sætte Action-PAINT i gang, vi startede med at demonstrere dens effektivitet ved mærkning af enkeltmolekyle-mål, der kun ligger 30 til 70 nm væk fra deres identiske naboer med høj on-target-effektivitet, " sagde co-first forfatter Ninning Liu, Ph.D., "og derefter yderligere valideret vores metode i fikserede celler, hvor vi udvalgte og mærkede mikrotubuliproteiner langs cytoskeletfilamenter, med forskellige specialdefinerede mønstre." Liu er postdoktor på Yins hold.
Forfatterne forestiller sig, at Action-PAINT kunne videreudvikles til et bredt anvendeligt værktøj, for eksempel, kunne hjælpe direkte med at modificere aktiviteterne af enkeltmembranreceptorer på overfladen af celler, hvorfra de dirigerer celleadfærd, eller af ionkanaler, der styrer funktionen af neuronale celler. Ud over, metoderne kunne tillade overførsel af molekylære håndtag til enkelte proteiner, der kan tillade deres ekstraktion og oprensning sammen med andre proteiner, de binder sig til naturligt.
"Action-PAINT tilføjer endnu et funktionalitetsniveau til de funktioner, der er udviklet af Peng Yins team, der kan muliggøre både molekylær positionsbaseret funktionel proteininteraktionskortlægning inde i individuelle celler, og biokemisk analyse af disse interaktioner, når disse molekyler er isoleret, som i fremtiden kan hjælpe med at identificere og/eller validere nye lægemiddelmål, " sagde Wyss Institutes stiftende direktør Donald Ingber, M.D., Ph.D.
 Varme artikler
Varme artikler
-
 Ny katalysator opnår hidtil usete aktiviteterPhilip Weber og Thorsten Scherpf (til venstre) var væsentligt involveret i eksperimenterne i laboratoriet. Kredit:Ruhr-Universitaet-Bochum Forskere har udviklet en ny katalysator til syntetisering
Ny katalysator opnår hidtil usete aktiviteterPhilip Weber og Thorsten Scherpf (til venstre) var væsentligt involveret i eksperimenterne i laboratoriet. Kredit:Ruhr-Universitaet-Bochum Forskere har udviklet en ny katalysator til syntetisering -
 Forbindelser, der giver kaffen sin karakteristiske mundfølelseKredit:Pixabay/CC0 Public Domain Kaffedrikke genkender intuitivt fornøjelsen ved at sluge en glat, rig bryg versus en vandig. Bortset fra tilsat fløde eller sukker, selve kaffen bidrager til denne
Forbindelser, der giver kaffen sin karakteristiske mundfølelseKredit:Pixabay/CC0 Public Domain Kaffedrikke genkender intuitivt fornøjelsen ved at sluge en glat, rig bryg versus en vandig. Bortset fra tilsat fløde eller sukker, selve kaffen bidrager til denne -
 Ny proces giver mere, renere RNA til en brøkdel af prisenEn hårnålesløjfe fra et præ-mRNA. Fremhævet er nukleobaserne (grøn) og ribose-phosphat-rygraden (blå). Bemærk, at dette er en enkelt streng af RNA, der foldes tilbage på sig selv. Kredit:Vossman/ Wiki
Ny proces giver mere, renere RNA til en brøkdel af prisenEn hårnålesløjfe fra et præ-mRNA. Fremhævet er nukleobaserne (grøn) og ribose-phosphat-rygraden (blå). Bemærk, at dette er en enkelt streng af RNA, der foldes tilbage på sig selv. Kredit:Vossman/ Wiki -
 Forskere opdager nøglemekanismen bag dannelsen af edderkoppesilkeKredit:CC0 Public Domain En gruppe videnskabsmænd ledet af forskere fra RIKEN Center for Sustainable Resource Science (CSRS) har undersøgt den opløselige forløber for edderkoppesilke og fundet ud
Forskere opdager nøglemekanismen bag dannelsen af edderkoppesilkeKredit:CC0 Public Domain En gruppe videnskabsmænd ledet af forskere fra RIKEN Center for Sustainable Resource Science (CSRS) har undersøgt den opløselige forløber for edderkoppesilke og fundet ud
- Et drys af platin nanopartikler på grafen gør hjernesonder mere følsomme
- Er der en mørk hastighed?
- Solbeskyttelse uden persienner
- Billede:Suomi NPP-satellit fanger igangværende brande i Alaska
- Ny forskning ser på gammastråleudbrud
- De amerikanske grundlæggere var besat af den amerikanske istids megafauna


