Hvilke store forskelle i elektronegativitetsresultat er binding mellem atomer?
Her er hvorfor:
* Elektronegativitet: Dette er et mål for et atoms evne til at tiltrække elektroner mod sig selv i en kemisk binding.
* Stor forskel: Når elektronegativitetsforskellen mellem to atomer er betydelig (generelt betragtet som større end 1,7), vil den mere elektronegative atom kraftigt tiltrække elektronerne i bindingen.
* Elektronoverførsel: Denne stærke attraktion fører til det mere elektronegative atom effektivt * tager * elektronet fra det mindre elektronegative atom. Dette skaber en kation (positivt ladet ion) fra atomet, der mister elektronet og en anion (negativt ladet ion) fra atomet, der får elektronet.
* Elektrostatisk attraktion: De modsatte afgifter for kationen og anionen tiltrækker derefter hinanden gennem elektrostatiske kræfter og danner en ionisk binding .
Eksempel: Natrium (NA) har en elektronegativitet på 0,93, mens klor (CL) har en elektronegativitet på 3,16. Denne store forskel fører til dannelsen af natriumchlorid (NaCl), hvor natrium mister et elektron til at blive Na+, og klor får et elektron til at blive Cl-. Disse ioner tiltrækker derefter hinanden gennem ionisk binding.
Nøglepunkt: Mens store forskelle i elektronegativitet fører til ioniske bindinger, fører mindre forskelle generelt til kovalente bindinger hvor elektroner deles mellem atomer.
 Varme artikler
Varme artikler
-
 Nyt madfrysningskoncept forbedrer kvaliteten, øger sikkerheden, reducerer energiforbrugetKredit:Unsplash/CC0 Public Domain Skift til en ny madfrysningsmetode kunne give sikrere og bedre kvalitet frosne fødevarer, samtidig med at der spares energi og reduceres kulstofemissioner, ifølge
Nyt madfrysningskoncept forbedrer kvaliteten, øger sikkerheden, reducerer energiforbrugetKredit:Unsplash/CC0 Public Domain Skift til en ny madfrysningsmetode kunne give sikrere og bedre kvalitet frosne fødevarer, samtidig med at der spares energi og reduceres kulstofemissioner, ifølge -
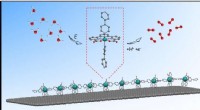 Oligomere materialer for at forbedre vandspaltningOligomer katalysator. Kredit:Marcos Gil-Sepulcre (ICIQ) Forskere fra Llobet-gruppen har udviklet et nyt molekylært materiale lavet af oligomerer og brugt det som en katalysator i vandoxidation, op
Oligomere materialer for at forbedre vandspaltningOligomer katalysator. Kredit:Marcos Gil-Sepulcre (ICIQ) Forskere fra Llobet-gruppen har udviklet et nyt molekylært materiale lavet af oligomerer og brugt det som en katalysator i vandoxidation, op -
 Det kræver to-en to-atomskatalysator, det vil sige - at lave ilt fra vandKredit:CC0 Public Domain Søgningen efter bæredygtige metoder til fremstilling af nye brændstoffer har bragt forskere tilbage til et af de mest rigelige materialer på jorden - rødligt jernoxid i fo
Det kræver to-en to-atomskatalysator, det vil sige - at lave ilt fra vandKredit:CC0 Public Domain Søgningen efter bæredygtige metoder til fremstilling af nye brændstoffer har bragt forskere tilbage til et af de mest rigelige materialer på jorden - rødligt jernoxid i fo -
 Ingeniører bruger varmefri teknologi til fleksibel elektronik, tryk metal på blomster, gelatineMartin Thuo og hans forskergruppe har udviklet varmefri teknologi, der kan printe ledende, metalliske linjer og spor på næsten alt, inklusive et rosenblad. Kredit:Martin Thuo. Martin Thuo fra Iowa
Ingeniører bruger varmefri teknologi til fleksibel elektronik, tryk metal på blomster, gelatineMartin Thuo og hans forskergruppe har udviklet varmefri teknologi, der kan printe ledende, metalliske linjer og spor på næsten alt, inklusive et rosenblad. Kredit:Martin Thuo. Martin Thuo fra Iowa
- Hvordan får du det andet derivat af potentiel energi?
- Sensorer fra verdens største digitalkamera snap first 3, 200 megapixel billeder på SLAC
- Er stjernen ved siden af Moon en satellitplanet eller stjerne?
- Hvorfor strømmer elektricitet gennem papir?
- Robotter, AI og droner:Hvornår blev legetøj til raketvidenskab?
- Smart materiale muliggør nye applikationer inden for autonom kørsel og robotik


