Hvorfor kaldes Tin II -klorid et reduktionsmiddel?
* Oxidation og reduktion: I en kemisk reaktion henviser oxidation til tab af elektroner, mens reduktion henviser til forstærkningen af elektroner.
* redoxreaktioner: Reaktioner, der involverer både oxidation og reduktion, kaldes redoxreaktioner.
* reduktionsmiddel: Et reduktionsmiddel er et stof, der får et andet stof til at reduceres (få elektroner). Det gør dette af sig selv at blive oxideret (miste elektroner).
hvordan SNCL₂ fungerer som et reduktionsmiddel:
1. tin (II) ion (sn²⁺): Tinionen i SnCl₂ har en +2 oxidationstilstand. Det kan let miste en anden elektron for at blive SN⁴⁺ (oxidation).
2. Elektronoverførsel: Når SnCl₂ reagerer med et andet stof, kan sn²⁺ion donere sit elektron til det andet stof, hvilket får det til at blive reduceret.
3. samlet effekt: Ved at miste en elektron og blive oxideret får SNCL₂ det andet stof til at få en elektron og blive reduceret. Dette gør SNCL₂ til et reduktionsmiddel.
Eksempel:
Overvej reaktionen af SNCL₂ med en løsning, der indeholder Fe³⁺ -ioner:
Sncl₂ + 2Fe³⁺ → Sncl₄ + 2Fe²⁺
I denne reaktion:
* Sn²⁺ oxideres til sn⁴⁺ (mister elektroner)
* Fe³⁺ reduceres til Fe²⁺ (Gains Electrons)
Da SNCL₂ forårsager reduktion af Fe³⁺, fungerer det som et reducerende middel i denne reaktion.
Kortfattet: Tin (II) -chloridets evne til at miste elektroner og blive oxideret gør det til et godt reduktionsmiddel. Det kan overføre elektroner til andre stoffer, hvilket får dem til at blive reduceret.
Sidste artikelNatriumsilikat og natriumhydroxid blandes sammen?
Næste artikelHvad er den kemiske sammensætning af fluorit?
 Varme artikler
Varme artikler
-
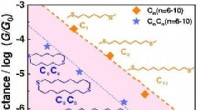 Stærkt isolerende alkanringe med destruktiv σ-interferensDe blå stjernetegn på mættede alkanringe viser eksponentielt henfaldskonduktans, og henfaldstendensen ligner mættede alkankæder, som præsenteres af orange firkanter. Alkanringene er mere isolerende en
Stærkt isolerende alkanringe med destruktiv σ-interferensDe blå stjernetegn på mættede alkanringe viser eksponentielt henfaldskonduktans, og henfaldstendensen ligner mættede alkankæder, som præsenteres af orange firkanter. Alkanringene er mere isolerende en -
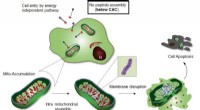 Forskere finder en ny måde at tackle kræftceller påFigur viser Intra-mitokondriel samling af Mito-FF. Kredit:UNIST Montering på stedet af amfifile peptider med ledsagende cellulære funktioner inde i en levende celle (dvs. intracellulær samling) og
Forskere finder en ny måde at tackle kræftceller påFigur viser Intra-mitokondriel samling af Mito-FF. Kredit:UNIST Montering på stedet af amfifile peptider med ledsagende cellulære funktioner inde i en levende celle (dvs. intracellulær samling) og -
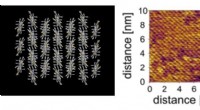 Cellemembran inspirerer til ny ultratynd elektronisk filmSet ovenfra af 3D-computermodel (venstre) og Atomic Force Microscopy-billede (højre) af den nye film lavet af videnskabsmænd fra University of Tokyo. Molekylernes velorganiserede struktur er synlig i
Cellemembran inspirerer til ny ultratynd elektronisk filmSet ovenfra af 3D-computermodel (venstre) og Atomic Force Microscopy-billede (højre) af den nye film lavet af videnskabsmænd fra University of Tokyo. Molekylernes velorganiserede struktur er synlig i -
 Monolitiske nanocarbon-katalysatorer starter selektiv oxidation af dihydrogensulfidDen monolitiske nanocarbon-katalysator præsenterer overlegen katalytisk ydeevne for H2S-selektiv oxidation med forbedret svovlselektivitet og urenhedstolerance. Kredit:XU Chi Ultradyb fjernelse af
Monolitiske nanocarbon-katalysatorer starter selektiv oxidation af dihydrogensulfidDen monolitiske nanocarbon-katalysator præsenterer overlegen katalytisk ydeevne for H2S-selektiv oxidation med forbedret svovlselektivitet og urenhedstolerance. Kredit:XU Chi Ultradyb fjernelse af
- Hvilken form for energi, der er gemt i lommelygte?
- Dens levested er decimeret, denne karismatiske Minnesota-fugl danser på kanten af glemsel
- Kan du beskrive de begivenheder, der finder sted, når energi fra sol rejser gennem en pyramide?
- Hvordan måles energien fra solen?
- Hvor lang tid tog det for Jorden at dreje sig om solen i 2000 f.Kr.?
- Udvikling af fluoralkylcarbonater for at gøre den farmaceutiske og kemiske industri renere og sikre…


