Hvad er den frysepunktdepression af en vandig opløsning, der indeholder 25,0 gram magnesiumchlorid?
1. Beregn molaliteten af opløsningen.
* molmasse mgcl₂: 24,31 g/mol (mg) + 2 * 35,45 g/mol (Cl) =95,21 g/mol
* mol mgcl₂: 25,0 g / 95,21 g / mol =0,263 mol
* Mass af vand (opløsningsmiddel): Antag, at du laver en opløsning på 1 kg (1000 g). Derfor er vandmassen 1000 g - 25,0 g =975 g =0,975 kg
* molalitet (m): mol opløsningsmiddel / kg opløsningsmiddel =0,263 mol / 0,975 kg =0,270 mol / kg
2. Beregn Van't Hoff -faktoren (i).
* mgcl₂ Dissocieres i 3 ioner i opløsning:mg²⁺ + 2Cl⁻. Derfor i =3.
3. Beregn frysepunktdepressionen (ΔT f ).
* frysningspunkt depression konstant (k f ) for vand: 1,86 ° C/m
* ΔT f =i * k f * M
* ΔT f =3 * 1,86 ° C/m * 0,270 m =1,50 ° C
Derfor er den frysepunktdepression af den vandige opløsning indeholdende 25,0 gram magnesiumchlorid 1,50 ° C.
Vigtig note: Denne beregning antager ideel opførsel, hvilket betyder, at opløstelsen fuldstændigt adskiller sig i ioner. I virkeligheden kan der forekomme en vis ionparring, hvilket ville reducere den faktiske frysepunktdepression.
 Varme artikler
Varme artikler
-
 Modellen lærer, hvordan individuelle aminosyrer bestemmer proteinfunktionenEn ny model udviklet af MIT-forskere skaber rigere, lettere beregnelige repræsentationer af, hvordan individuelle aminosyrer bestemmer et proteins funktion, som kunne bruges til at designe og teste ny
Modellen lærer, hvordan individuelle aminosyrer bestemmer proteinfunktionenEn ny model udviklet af MIT-forskere skaber rigere, lettere beregnelige repræsentationer af, hvordan individuelle aminosyrer bestemmer et proteins funktion, som kunne bruges til at designe og teste ny -
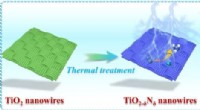 Overfladedefektkonstruktion af nanowire-arrays mod effektiv nitrogenreduktion til ammoniaksynteseKatalysatorerne er baseret på TiO2−δ Nδ nanotråde dyrket på kulstof har et højere udbytte for ammoniak end elektrokatalysatoren uden N-doping. Kredit:Journal of Energy Chemistry Ammoniak er en kul
Overfladedefektkonstruktion af nanowire-arrays mod effektiv nitrogenreduktion til ammoniaksynteseKatalysatorerne er baseret på TiO2−δ Nδ nanotråde dyrket på kulstof har et højere udbytte for ammoniak end elektrokatalysatoren uden N-doping. Kredit:Journal of Energy Chemistry Ammoniak er en kul -
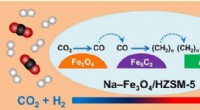 Forskere udvikler en effektiv multifunktionel katalysator til CO2-hydrogenering til benzinCO2-hydrogenering til carbonhydrider i benzinområdet over Na-Fe3O4/Zeolite multifunktionel katalysator. Kredit:WEI Jian Konvertering af CO2 fra en skadelig drivhusgas til værdiskabende flydende br
Forskere udvikler en effektiv multifunktionel katalysator til CO2-hydrogenering til benzinCO2-hydrogenering til carbonhydrider i benzinområdet over Na-Fe3O4/Zeolite multifunktionel katalysator. Kredit:WEI Jian Konvertering af CO2 fra en skadelig drivhusgas til værdiskabende flydende br -
 Forskere skaber ny aluminiumslegering med fleksibilitet, styrke, lethedDetaljer lavet af Al-Ni-La kompositmateriale Kredit:© Sergey Gnuskov/NUST MISIS Aluminium er et af de mest lovende materialer til luftfarts- og bilindustrien. Forskere fra National University of S
Forskere skaber ny aluminiumslegering med fleksibilitet, styrke, lethedDetaljer lavet af Al-Ni-La kompositmateriale Kredit:© Sergey Gnuskov/NUST MISIS Aluminium er et af de mest lovende materialer til luftfarts- og bilindustrien. Forskere fra National University of S
- Hvorfor er der ikke kun en korrekt videnskabelig proces?
- Mindst 265 døde i oversvømmelser, jordskred, mens regnen rammer Østafrika
- Hvilket grundstof findes i alle organiske molekyler?
- Forskere bruger 3-D printer til at printe glas
- Hvilken lov beskriver forholdet mellem volumen og temperatur på en gas, når trykket er konstant?
- Nationalisme fra international sport kan øge internationale konflikter


