Hvordan er de elleve elektroner af natriumatom arrangeret?
Elektronkonfiguration:
* 1S² 2S² 2p⁶ 3S¹
sammenbrud:
* 1S²: Det første energiniveau (n =1) har et (er), som kan indeholde op til 2 elektroner. Så 1S -sublet er fyldt med 2 elektroner.
* 2s²: Det andet energiniveau (n =2) har også et S -sublevel, der er fyldt med 2 elektroner.
* 2p⁶: Det andet energiniveau har også et P -underniveau, der kan indeholde op til 6 elektroner. Dette subles er fuldstændigt fyldt.
* 3s¹: Det tredje energiniveau (n =3) har et S -sublevel, der kun indeholder 1 elektron.
forenklet repræsentation:
* [ne] 3s¹ Dette er en kortvarig notation ved hjælp af elektronkonfigurationen af den forrige ædle gas (neon), [NE], efterfulgt af den resterende elektron i 3S -underniveauet.
Nøglepunkter:
* Energiniveau: Elektroner er organiseret i energiniveauet, hvor højere antal repræsenterer højere energiniveau.
* Sublers: Inden for hvert energiniveau er der subles (S, P, D, F) med forskellige former og energier.
* Elektronfyldning: Elektroner udfylder underniveauer i rækkefølge af stigende energi efter Aufbau -princippet.
* valenselektron: Den yderste elektron (3S¹) i natrium kaldes valenselektronen og er ansvarlig for natriums kemiske reaktivitet.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse punkter!
 Varme artikler
Varme artikler
-
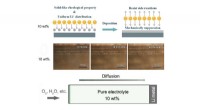 Hydrofob silica kolloid elektrolyt lover sikrere lithium-oxygen batterierSkematisk graf og eksperimentelle data, der viser den lithiumdendritforebyggende effekt af 10 vægt% HSCE. Skematisk graf og eksperimentelle data, der viser antikorrosionseffekten af 10 vægt% HSCE. K
Hydrofob silica kolloid elektrolyt lover sikrere lithium-oxygen batterierSkematisk graf og eksperimentelle data, der viser den lithiumdendritforebyggende effekt af 10 vægt% HSCE. Skematisk graf og eksperimentelle data, der viser antikorrosionseffekten af 10 vægt% HSCE. K -
 Makromolekylær krystallografi kaster lys over en ny måde at målrette mod malariaparasittenKrystalstruktur af Cryptosporidium parvum Lysyl tRNA-synthetase (CpKRS) bundet til et nyt lille molekyle, der er aktivt mod apicomplexan-parasitterne Plasmodium falciparum og Cryptosporidium parvum.
Makromolekylær krystallografi kaster lys over en ny måde at målrette mod malariaparasittenKrystalstruktur af Cryptosporidium parvum Lysyl tRNA-synthetase (CpKRS) bundet til et nyt lille molekyle, der er aktivt mod apicomplexan-parasitterne Plasmodium falciparum og Cryptosporidium parvum. -
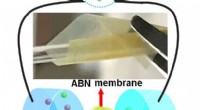 Membran inspireret af knogler og brusk producerer effektivt elektricitet fra saltvandDette diagram viser bio-inspirerede nanokompositmembraner til effektiv høst af blå energi. Kredit:Chen et al. Inspireret af membraner i levende organismers kropsvæv, forskere har kombineret aramid
Membran inspireret af knogler og brusk producerer effektivt elektricitet fra saltvandDette diagram viser bio-inspirerede nanokompositmembraner til effektiv høst af blå energi. Kredit:Chen et al. Inspireret af membraner i levende organismers kropsvæv, forskere har kombineret aramid -
 Anti-degranulering og galdesyrebindende aktivitet af frugter og agroindustrielle biprodukterKredit:Anna Langova/Public Domain De ubrugte dele af frugt og grøntsager, såsom frugtkød efter juicening, indeholder ofte flere fytokemikalier med bioregulerende funktioner end de brugte dele, men
Anti-degranulering og galdesyrebindende aktivitet af frugter og agroindustrielle biprodukterKredit:Anna Langova/Public Domain De ubrugte dele af frugt og grøntsager, såsom frugtkød efter juicening, indeholder ofte flere fytokemikalier med bioregulerende funktioner end de brugte dele, men
- Hvordan sammenlignes kredsløbet af ydre planeter med indre?
- Videnskaben bag æget Drop Experiment
- Manglende gammastråleblopper kaster nyt lys over mørkt stof, kosmisk magnetisme
- Hvad er navnet sted, hvor vand er udtømmer fra jorden?
- Hvem producerer sund energi?
- Farveændringsurintest for kræft viser potentiale i museundersøgelse


