Hvorfor opfører natriumchlorid elektricitet i krystallinsk form?
* ionisk binding: Natriumchlorid er en ionisk forbindelse, hvilket betyder, at det dannes af den elektrostatiske tiltrækning mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-). Disse ioner er arrangeret i en stiv, krystallinsk gitter.
* faste ioner: I fast tilstand holdes disse ioner i faste positioner inden for krystalstrukturen. De kan ikke bevæge sig frit, hvilket er afgørende for elektrisk ledningsevne.
* Ingen gratis opladningsbærere: For at et stof skal gennemføre elektricitet, har det brug for gratis ladningsselskaber, der kan bevæge sig og bære en elektrisk strøm. I faste NaCl er der ingen frie elektroner eller ioner for at lette denne bevægelse.
Her er, hvordan NaCl udfører elektricitet:
* smeltet tilstand (væske): Når NaCl er smeltet, går de ioniske bindinger, og ionerne bliver frie til at bevæge sig rundt. Disse mobile ioner fungerer som ladningsbærere, hvilket giver den smeltede NaCl mulighed for at udføre elektricitet.
* vandig løsning: Når det er opløst i vand, adskiller NaCl sig i dens bestanddele (Na+ og Cl-), som igen er fri til at bevæge sig, hvilket gør opløsningen til en elektrisk leder.
Kortfattet: Fast natriumchlorid udfører ikke elektricitet, fordi dets ioner er fikseret i krystalgitteret. Først når det er i en smeltet tilstand eller opløst i vand, giver de frie ioner mulighed for elektrisk ledningsevne.
Sidste artikelHvordan påvirker syre og baser vandluftforurening?
Næste artikelHvad er den kemiske formel for metal?
 Varme artikler
Varme artikler
-
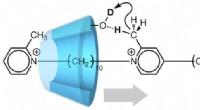 Molekylær maskine udnytter bevægelse i en enkelt retningFig.1. En pseudo-rotaxan (kunstig molekylær maskine), hvor translationel bevægelse af α-cyclodextrin (α-CD) falder sammen med deuteration. Når α-CD bevæger sig langs to-stationsaksemolekylet som vist
Molekylær maskine udnytter bevægelse i en enkelt retningFig.1. En pseudo-rotaxan (kunstig molekylær maskine), hvor translationel bevægelse af α-cyclodextrin (α-CD) falder sammen med deuteration. Når α-CD bevæger sig langs to-stationsaksemolekylet som vist -
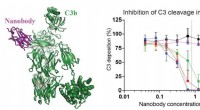 Et lille protein med mange anvendelsesmulighederVenstre panel af figuren viser strukturen af det nyudviklede nanolegeme (magenta) bundet til et C3-fragment kaldet C3b (grøn). I de rigtige paneler, data, der viser, at nanostoffet og mutanterne her
Et lille protein med mange anvendelsesmulighederVenstre panel af figuren viser strukturen af det nyudviklede nanolegeme (magenta) bundet til et C3-fragment kaldet C3b (grøn). I de rigtige paneler, data, der viser, at nanostoffet og mutanterne her -
 Et robust materiale til optagelse og opbevaring af ammoniak ved tætheder, der kommer tæt på den f…Kredit:Wiley Håndtering, opbevaring, og forsendelse af ammoniak kræver dyrt udstyr og særlige forholdsregler på grund af dets iboende ætsende og toksiske egenskaber. Forskere i Manchester, Storbri
Et robust materiale til optagelse og opbevaring af ammoniak ved tætheder, der kommer tæt på den f…Kredit:Wiley Håndtering, opbevaring, og forsendelse af ammoniak kræver dyrt udstyr og særlige forholdsregler på grund af dets iboende ætsende og toksiske egenskaber. Forskere i Manchester, Storbri -
 Metalorganiske rammer reducerer energiforbruget af petrokemikalierUltratynd MOF -membran på kommerciel polymerunderstøttelse. Kredit:K.V. Agrawal/EPFL I den kemiske og den petrokemiske industri, at adskille molekyler på en energieffektiv måde er en af de vigti
Metalorganiske rammer reducerer energiforbruget af petrokemikalierUltratynd MOF -membran på kommerciel polymerunderstøttelse. Kredit:K.V. Agrawal/EPFL I den kemiske og den petrokemiske industri, at adskille molekyler på en energieffektiv måde er en af de vigti
- Hjælp en gasvaparat, når den afkøles?
- Forskere finder en måde at kontrollere, at kvantecomputere returnerer nøjagtige svar
- Team udvikler natriumionbatterier ved hjælp af kobbersulfid
- Klimaændringer kan bringe mere ekstrem varme, ozonforureningsdage til sydøst, siger forskere
- Tørke ødelægger Californiens reservoirer som varme, tørre sommer væver
- Hvordan dyrkes Penicillin til et Science Project


