Et lille protein med mange anvendelsesmuligheder
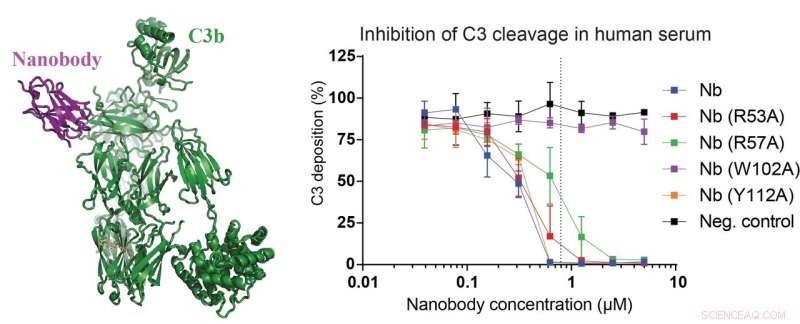
Venstre panel af figuren viser strukturen af det nyudviklede nanolegeme (magenta) bundet til et C3-fragment kaldet C3b (grøn). I de rigtige paneler, data, der viser, at nanostoffet og mutanterne heraf er i stand til at hæmme spaltningen af C3 i 15 procent humant serum. Forskerne konstruerede også en nanobody-mutant, der fuldstændigt mister sin hæmmende effekt på C3-spaltning (lilla kurve), hvilket gør den til en perfekt negativ kontrol. Kredit:Rasmus Kjeldsen Jensen og Janus Asbjørn Schatz-Jakobsen, Aarhus Universitet
Forskere fra Institut for Molekylærbiologi og Genetik og fra Institut for Biomedicin ved Aarhus Universitet har i samarbejde udviklet og beskrevet et lama-antistof, der kan have væsentlig betydning for fremtidig diagnostik og behandling af, f.eks., nyresygdomme.
Forskerholdet undersøgte et protein kaldet C3 fra den del af det medfødte immunsystem kendt som komplementsystemet. Ved genkendelse af patogene organismer eller døende kropsceller, C3 spaltes af blodenzymer som en del af en forsvarsmekanisme. Disse enzymer er kendt som C3-konvertaser, og spaltningen af C3 resulterer i to fragmenter. Fragmentet kaldet 3b binder sig direkte til patogenerne, mens det andet fragment rekrutterer og stimulerer immunceller til at eliminere målet.
Hos en sund person, celler er beskyttet mod virkningerne af C3-spaltning. Imidlertid, som følge af mutationer i DNA, denne beskyttelse kan gå tabt, øger risikoen for at udvikle kroniske inflammatoriske lidelser eller autoimmune sygdomme. I lang tid, forskerne har fokuseret på at udvikle midler, der forhindrer sådan uønsket komplementaktivering. Af denne grund, de udviklede lama-antistoffet for at forhindre spaltning af C3. Lama-antistoffer er også kendt som nanobodies på grund af deres lille størrelse, og sammenlignet med normale antistoffer, de er nemme at udvikle og væsentligt billigere at producere.
"Teknologien, der bruges til at udvikle og producere disse nanobodies, har været kendt i mere end to årtier, " siger Gregers Rom Andersen. "Og derfor, det er noget overraskende, at vi er de første i verden til at udvikle en nanobody, der hæmmer komplementsystemet."
Ved at udsætte krystaller for røntgenstråler og korrelere resultaterne med data fra elektronmikroskopi, forskerne har beskrevet, hvordan deres nanobody binder C3 i store detaljer.
"Krystalstrukturen af vores nanobody bundet til C3 understøtter vores tidligere foreslåede modeller, der beskriver, hvordan komplementkonvertaserne genkender deres substrater og forklarer derfor klart, hvorfor vores nanobody udøver sin hæmmende effekt på spaltningen af C3. Vores resultater forbedrer også den grundlæggende forståelse af, hvordan dette essentiel mekanisme i komplementsystemet virker. Ved at sammenligne med tidligere offentliggjorte proteinstrukturer, vi kan desuden forklare, hvorfor vores nanobody hæmmer dannelsen af C3-konvertaserne, vores nanobody har en "dobbelt hæmmende" effekt så at sige, " forklarer Rasmus Kjeldsen Jensen.
Ud over arbejdet med at beskrive C3-nanobody-komplekset, forskerholdet har også udført adskillige laboratorieforsøg med serum fra både mus og mennesker. Disse resultater bekræfter observationerne fra atomstrukturen og afslører klart, at deres nyudviklede nanobody hæmmer spaltningen af C3 i både humant og murint serum. Det sidste er vigtigt, da mus ofte bruges som sygdomsmodeller.
"Vores eksperimenter med serum er vigtige, da de viser, at vores nanobody faktisk arbejder under fysiologiske forhold, hvor komplementsystemet naturligt udøver sin funktion. Disse resultater indikerer, at vores nanobody kunne bruges til behandling af sygdomme forårsaget af overaktivering af komplementsystemet. Som et eksempel, en del af nyren er ikke beskyttet mod komplement i samme grad som andre væv, og i dette tilfælde kunne vores nanobody være en kandidat til at stoppe komplementdrevet sygdomsprogression, " siger Gregers Rom Andersen. "Men vi fandt også ud af, at vores nanobody er i stand til at hæmme de beskyttende virkninger, vores egen krop normalt har mod komplement, og man bør derfor være meget forsigtig og omhyggeligt vurdere de mulige bivirkninger af terapeutisk behandling af sygdomme ved hjælp af vores nanobody, " slutter Gregers Rom Andersen.
Grundlaget for dette arbejde er etableret af de to adjunkter Kasper Røjkjær Andersen og Nick Stub Laursen fra Institut for Molekylær Biologi og Genetik, som var de første i Danmark til systematisk at udvikle og producere storskala nanobodies. Imidlertid, drivkraften i projektet var ph.d.-studerende Rasmus Kjeldsen Jensen under vejledning af professor Gregers Rom Andersen, der i karakteriseringen af nanobody'et blev assisteret af de to ph.d.-studerende Trine Amalie Fogh Gadeberg og Rasmus Pihl.
 Varme artikler
Varme artikler
-
 Hæft sukker til proteinEnzymet oligosaccharyltransferase er placeret i membranen (grå) og består af otte underenheder. Kredit:Julia Kowal / ETH Zürich ETH-forskere er lykkedes med at bestemme 3-D-strukturen af enzymet
Hæft sukker til proteinEnzymet oligosaccharyltransferase er placeret i membranen (grå) og består af otte underenheder. Kredit:Julia Kowal / ETH Zürich ETH-forskere er lykkedes med at bestemme 3-D-strukturen af enzymet -
 Forskere bruger berøringsfri udskrivningsmetode til testning af store mængder antibiotikaAt finde den bedste behandling mod bakterielle infektioner er altid udfordrende. Forskere fra laboratoriet for mikrofluidik og komplekse væsker, IPC PAS opfandt en mikrofluid enhed, der gør det muligt
Forskere bruger berøringsfri udskrivningsmetode til testning af store mængder antibiotikaAt finde den bedste behandling mod bakterielle infektioner er altid udfordrende. Forskere fra laboratoriet for mikrofluidik og komplekse væsker, IPC PAS opfandt en mikrofluid enhed, der gør det muligt -
 Ny teknik bringer studiet af molekylær konfiguration ind i det mikroskopiske domæneRohit Bhargava med postdoktor Kevin Yeh, der designede det brugerdefinerede infrarøde mikroskop, der blev brugt til denne undersøgelse. Dette foto er taget i februar 2020. Kredit:L. Brian Stauffer, Un
Ny teknik bringer studiet af molekylær konfiguration ind i det mikroskopiske domæneRohit Bhargava med postdoktor Kevin Yeh, der designede det brugerdefinerede infrarøde mikroskop, der blev brugt til denne undersøgelse. Dette foto er taget i februar 2020. Kredit:L. Brian Stauffer, Un -
 Ny konfiguration af DNA opdagetDNA strækkes mellem to (polystyren) perler (blå), der holdes i laserstråler (rød). Interkalatorer (grønne) gør hyperstrakt DNA synligt. Kredit:Iddo Heller / VU Amsterdam Hvis man trækker tilstrækk
Ny konfiguration af DNA opdagetDNA strækkes mellem to (polystyren) perler (blå), der holdes i laserstråler (rød). Interkalatorer (grønne) gør hyperstrakt DNA synligt. Kredit:Iddo Heller / VU Amsterdam Hvis man trækker tilstrækk
- Forskning afslører den tidligste flyverelaterede smeltningsstrategi i 150 millioner år gammel fugl
- Tågerobotik:En ny tilgang til at opnå effektiv og flydende menneske-robot-interaktion
- Små plastikpartikler fra tøj, dæk, der tilstopper havene:rapport
- Krøllet grafen gør ultra-følsom kræft-DNA-detektor
- Dynetics færdiggør bygningen af fuldskala testartikel for menneskelig landingssystem til evaluer…
- Bærbar plasmonisk-metasurface-sensor til universel molekylær fingeraftryksdetektion på biogrænse…


