Nær-infrarøde fotoaktiverbare oxygeneringskatalysatorer af amyloidpeptid
Kredit:Japan Science and Technology Agency (JST)
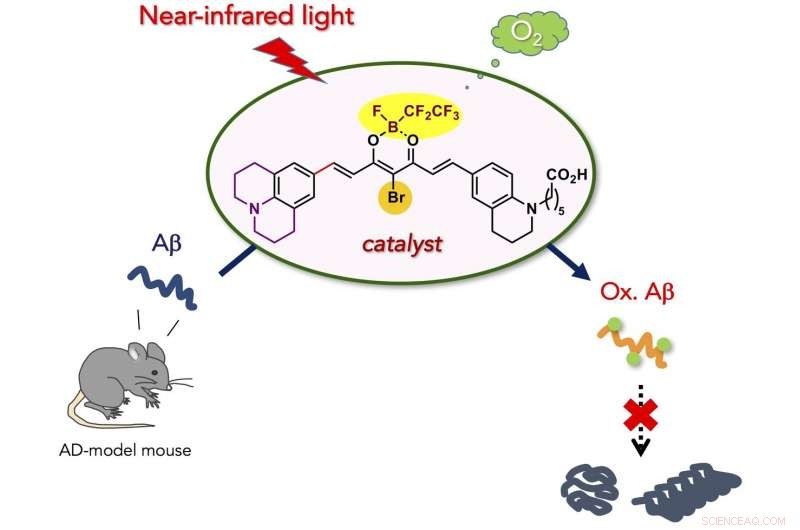
En ny, Der er udviklet biokompatibel fotooxygeneringskatalysator, der selektivt kan ilte og nedbryde den patogene aggregering af Alzheimers sygdom (AD)-relateret amyloid-β-peptid (Aβ) under nær-infrarød (NIR) lysbestråling. Katalysatoren var i stand til at ilte Aβ indlejret under huden på en levende mus, og formindsket intakt Ap-niveau i AD-model musehjerne. Den nye katalysator er potentielt anvendelig til behandling af perifere amyloidsygdomme og AD.
Toksisk aggregering af amyloid peptid og protein er tæt forbundet med en række menneskelige sygdomme. Amyloid-β (Aβ) er et repræsentativt amyloidpeptid, hvis aggregering er relateret til patogenesen af Alzheimers sygdom (AD). Udviklingen af et kunstigt kemisk system, der selektivt omdanner giftige amyloidaggregater til ikke-toksiske arter under fysiologiske forhold, derved potentielt undertrykke den patogene proces, kunne være en ny terapeutisk strategi til behandling af aktuelt uhelbredelige amyloidsygdomme, herunder AD.
Forskerne forestillede sig, at fotokatalyseret aerob iltning ville være en passende kemisk reaktion til at svække de patogene aggregative egenskaber af Aβ under fysiologiske forhold. Fordi peptid- og proteinaggregering generelt afhænger af intermolekylære hydrofobe interaktioner, kovalent installation af hydrofile oxygenatomer til et peptid eller protein (dvs. iltning) ville reducere den aggregative egenskab. Vi har tidligere rapporteret, at aerob iltning af Aβ fortsætter i nærvær af Flavin (vitamin B2)-baserede fotokatalysatorer, og det resulterende oxygenerede Aβ udviser meget lav aggregeringsevne og toksicitet. Derefter, mere selektive fotooxygeneringskatalysatorer, aktiveres kun, når der registreres en giftig højere ordens amyloidstruktur, blev udviklet baseret på en fluorescensprobe for aggregeret amyloid peptid og protein. In vivo anvendelse af katalysatorerne var, imidlertid, umuligt, fordi bestråling med synligt lys, som har lav vævsgennemtrængning, var nødvendig for katalysatorexcitation. Til in vivo applikation, fotokatalysatorer skal kunne fungere under excitation med lys med længere bølgelængde, omtalt som det "optiske vindue", hvor levende væv absorberer relativt lidt lys.
Her, vi udviklede biokompatibel fotooxygeneringskatalysator, der selektivt kan ilte og nedbryde den patogene aggregering af Aβ under nær-infrarød (NIR) lysbestråling. Katalysatoren udviste fire hovedfordele sammenlignet med de tidligere katalysatorer til nedbrydning af aggregeret og toksisk Aβ:(1) Høj selektivitet for aggregeret Aβ, der stammer fra den højere ordens amyloidstruktur-følende tænd/sluk-kontakt for katalysatoraktiviteten. Den præcise målselektivitet muliggjorde fotooxygenering af aggregeret Aβ i nærværelse af cellerne og i musehjernelysat. (2) Lav toksicitet for cellerne. Strukturel optimering af katalysatoren reducerede markant cytotoksiciteten, både i mørke og under NIR-bestråling. (3) Høj iltningsstyrke under NIR-fotobestråling. På grund af vævspermeabilitet af NIR-lys, fotooxygenering af aggregeret Aβ under musehuden var mulig i højt udbytte. (4) Anvendelse på den levende dyrehjerne in vivo. Injektion af katalysatoren til AD-modellens musehjerne sammen med NIR-lysbestråling førte til signifikant fald i det intakte Aβ-niveau i hjernen. Resultaterne opnået i denne undersøgelse er et vigtigt skridt til at bruge kunstig katalyse som en potentiel terapeutisk strategi mod amyloidsygdomme.
Sidste artikelEt lille protein med mange anvendelsesmuligheder
Næste artikelForskere efterligner neuralt væv
 Varme artikler
Varme artikler
-
 Roll-up fjernsyn og bøjelige smartphones:Fremtiden for fleksible elektroniske materialerEn måde at visualisere dele af PCDTPT på, de ledende plastmaterialeforskere studeret i dette arbejde, er som en samling af gummiorm. Kredit:Sean Kelley/NIST Har du hørt om foldbare smartphones? Hv
Roll-up fjernsyn og bøjelige smartphones:Fremtiden for fleksible elektroniske materialerEn måde at visualisere dele af PCDTPT på, de ledende plastmaterialeforskere studeret i dette arbejde, er som en samling af gummiorm. Kredit:Sean Kelley/NIST Har du hørt om foldbare smartphones? Hv -
 Hvad er et opløsningsmiddel?Løsninger findes overalt. Tårerne i dine øjne er en opløsning af vand og salt, og nektar i blomster er en opløsning af vand og sukker. Inden for kemi og biologi består en opløsning af et opløsningsmid
Hvad er et opløsningsmiddel?Løsninger findes overalt. Tårerne i dine øjne er en opløsning af vand og salt, og nektar i blomster er en opløsning af vand og sukker. Inden for kemi og biologi består en opløsning af et opløsningsmid -
 Ny metode til mærkning af DNA -baser til sekventeringElektrokemisk kodning af DNA -baser. Kredit:Instituttet for organisk kemi og biokemi i CAS Et internationalt forskerhold ledet af Michal Hocek fra Institut for Organisk Kemi og Biokemi ved Det Tje
Ny metode til mærkning af DNA -baser til sekventeringElektrokemisk kodning af DNA -baser. Kredit:Instituttet for organisk kemi og biokemi i CAS Et internationalt forskerhold ledet af Michal Hocek fra Institut for Organisk Kemi og Biokemi ved Det Tje -
 Nye salte hæver barren for lithium-ion-batteriteknologiForskere håber at gøre disse nye anioner til termisk stabile, ikke-brændbare flydende salte, hvilket gør dem gavnlige for batterier, der arbejder ved høje temperaturer. Kredit:Monash University Li
Nye salte hæver barren for lithium-ion-batteriteknologiForskere håber at gøre disse nye anioner til termisk stabile, ikke-brændbare flydende salte, hvilket gør dem gavnlige for batterier, der arbejder ved høje temperaturer. Kredit:Monash University Li
- Mærkeligt liv
- Grønland skroter al fremtidig olieefterforskning
- Forskere udvikler metode til inkjet-print med høj ledningsevne, bøjelige lag af grafen
- Undersøgelse viser, at turistindustrien betaler de laveste lønninger i hele landet
- Kenya forbyder plastikposer for at bekæmpe forurening
- Hvad CES 2020 lærte os om årets telefoner:Billigere foldbare, 5G og mere


