Hvor mange molekyler er der i 65 g sølvnitrat?
1. Beregn den molære masse af sølvnitrat:
* AG:107,87 g/mol
* N:14,01 g/mol
* O:16,00 g/mol (x3 for tre iltatomer)
* Samlet molmasse:107,87 + 14,01 + (16,00 x 3) =169,88 g/mol
2. Beregn antallet af mol sølvnitrat:
* Mol =masse / molær masse
* Mol =65 g / 169,88 g / mol
* Mol ≈ 0,383 mol
3. Konverter mol til molekyler ved hjælp af Avogadro's nummer:
* Avogadros nummer:6,022 x 10²³ molekyler/mol
* Antal molekyler =mol X Avogadro's nummer
* Antal molekyler ≈ 0,383 mol x 6,022 x 10²³ molekyler/mol
* Antal molekyler ≈ 2,30 x 10²³ molekyler
Derfor er der ca. 2,30 x 10²³ molekyler i 65 g sølvnitrat.
 Varme artikler
Varme artikler
-
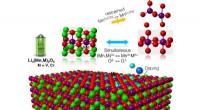 Forskere forudser materialer til at stabilisere et lithium-ion-batteri med rekordhøj kapacitetEn skematisk illustration af batteriets katodestruktur, hvor litium er rødt, ilt er grønt, mangan er lilla, krom er mørkeblå og vanadium er lyseblå. Kredit:Wolverton Research Group, Northwestern Unive
Forskere forudser materialer til at stabilisere et lithium-ion-batteri med rekordhøj kapacitetEn skematisk illustration af batteriets katodestruktur, hvor litium er rødt, ilt er grønt, mangan er lilla, krom er mørkeblå og vanadium er lyseblå. Kredit:Wolverton Research Group, Northwestern Unive -
 Udvikling af en ny billig galliumnitrid (GaN) krystalfremstillingsenhedUdseende af THVPE krystalvækstovn. Kredit:Taiyo Nippon Sanso Co. JST annoncerer den succesrige udvikling af en højkvalitets bulk GaN vækstenhed baseret på THVPE-metoden, et udviklingsemne for det
Udvikling af en ny billig galliumnitrid (GaN) krystalfremstillingsenhedUdseende af THVPE krystalvækstovn. Kredit:Taiyo Nippon Sanso Co. JST annoncerer den succesrige udvikling af en højkvalitets bulk GaN vækstenhed baseret på THVPE-metoden, et udviklingsemne for det -
 Skabelon til at skabe superatomer kunne give bedre batterierKredit:ktsdesign, Shutterstock Virginia Commonwealth University-forskere har opdaget en ny strategi til at skabe superatomer - kombinationer af atomer, der kan efterligne egenskaberne af mere end
Skabelon til at skabe superatomer kunne give bedre batterierKredit:ktsdesign, Shutterstock Virginia Commonwealth University-forskere har opdaget en ny strategi til at skabe superatomer - kombinationer af atomer, der kan efterligne egenskaberne af mere end -
 Undersøgelse af atomstruktur af aluminiumslegeringer til fremstilling af moderne flyKredit:Pixabay/CC0 Public Domain Forskere fra Belgorod State University (BSU) og Skolkovo Institute of Science and Technology (Skoltech) studerede aluminiumslegeringer på atomniveau og fandt mønstr
Undersøgelse af atomstruktur af aluminiumslegeringer til fremstilling af moderne flyKredit:Pixabay/CC0 Public Domain Forskere fra Belgorod State University (BSU) og Skolkovo Institute of Science and Technology (Skoltech) studerede aluminiumslegeringer på atomniveau og fandt mønstr
- Plastik, der redder planeten? Nystartet harpiks hjælper industrien med at blive grøn
- Satellit viser Pilar reduceret til rester
- Hvorfor er gaskedler mere effektive end elektriske brande?
- Årsagen blåhvaler er ikke endnu større? Deres Hearts
- Hvorfor bliver geotermisk energi ikke brugt alle steder?
- Energi kan overføres gennem tomt rum af hvad?


