Hvad er sandt med spontane reaktioner, når man tænker på kemiske systemer?
nøglekoncepter
* spontan reaktion: En reaktion, der opstår uden nogen ekstern input af energi. Disse reaktioner fortsætter i en retning, der øger systemets samlede stabilitet.
* gibbs fri energi (ΔG): En termodynamisk mængde, der forudsiger spontaniteten af en reaktion.
* entropi (ΔS): Et mål for forstyrrelse eller tilfældighed i et system.
* entalpi (ΔH): Et mål for varmeenergiændringen i en reaktion.
Hvad er sandt med spontane reaktioner:
1. Det definerende kendetegn ved en spontan reaktion. En negativ ΔG indikerer, at produkterne har lavere fri energi end reaktanterne, hvilket gør reaktionen energisk gunstig.
2. øget entropi (ΔS> 0): Spontane reaktioner har en tendens til at øge systemets lidelse eller tilfældighed. Dette betyder ikke, at de altid fører til rodede produkter, men det samlede system bliver mindre bestilt.
3. kan være endotermisk eller eksoterm:
* eksotermiske reaktioner (ΔH <0): Slip varme i omgivelserne, hvilket bidrager til spontanitet.
* endotermiske reaktioner (ΔH> 0): Absorbere varme fra omgivelserne. For at disse reaktioner skal være spontan, skal stigningen i entropi være stor nok til at overvinde den ugunstige entalpi -ændring.
4. Ikke nødvendigvis hurtig: Spontanitet henviser til reaktionens tendens til at forekomme, ikke dens hastighed. Nogle spontane reaktioner sker meget langsomt på grund af høje aktiveringsenergibarrierer.
Vigtige overvejelser
* Betingelser betyder noget: Spontanitet kan afhænge af temperatur, tryk og koncentration. En reaktion kan være spontan under et sæt betingelser og ikke-spontan under et andet.
* ligevægt: Mens en spontan reaktion favoriserer produktdannelse, betyder det ikke, at reaktionen går til færdiggørelse. Til sidst nås en tilstand af ligevægt, hvor hastighederne for fremadrettede og omvendte reaktioner er ens.
Lad mig vide, om du vil udforske specifikke eksempler eller gå dybere ned i de termodynamiske principper bag spontane reaktioner.
Sidste artikelHvilken type stof er klor?
Næste artikelHvad er et bedre eksempel på sammensat guldjod sand eller vand?
 Varme artikler
Varme artikler
-
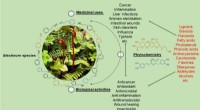 Forskere gennemgår anvendelser, fytokemi og farmakologiske egenskaber af slægten BlechnumMedicinsk anvendte Blechnum-planter. Kredit:WBG Flere værdifulde bregner, der tilhører slægten Blechnum, driver fra gård til traditionel helbredelse og etnofarmakologi, og er potentielle midler til
Forskere gennemgår anvendelser, fytokemi og farmakologiske egenskaber af slægten BlechnumMedicinsk anvendte Blechnum-planter. Kredit:WBG Flere værdifulde bregner, der tilhører slægten Blechnum, driver fra gård til traditionel helbredelse og etnofarmakologi, og er potentielle midler til -
 Genanvendelige stofmasker holder efter et års vask, tørringForskellige prøver, der blev brugt i denne undersøgelse, er vist fra øverst til højre til bund i urets retning:N95 respirator, KN95 åndedrætsværn, kirurgisk maske, vask/tør prøve kupon, 2-lags bandana
Genanvendelige stofmasker holder efter et års vask, tørringForskellige prøver, der blev brugt i denne undersøgelse, er vist fra øverst til højre til bund i urets retning:N95 respirator, KN95 åndedrætsværn, kirurgisk maske, vask/tør prøve kupon, 2-lags bandana -
 Forskere får et atomistisk billede af platinkatalysatornedbrydningRøntgendiffraktionsopsætning ved ID31-strålelinje, European Synchrotron Radiation Facility. Kredit:Natalie Stubb Nedbrydning af platin, bruges som et nøgleelektrodemateriale i brintøkonomien, fork
Forskere får et atomistisk billede af platinkatalysatornedbrydningRøntgendiffraktionsopsætning ved ID31-strålelinje, European Synchrotron Radiation Facility. Kredit:Natalie Stubb Nedbrydning af platin, bruges som et nøgleelektrodemateriale i brintøkonomien, fork -
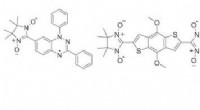 Overvindelse af udfordringerne med kontrolleret termisk aflejring af organiske diradikale stofferVenstre panel:Diradikalerne undersøgt i dette arbejde. Højre panel:Skitse af forskellige film (grøn farve) afsat på et underlag (grå farve). Kredit:Tuebingen Universitet Magnetisme er en egenskab
Overvindelse af udfordringerne med kontrolleret termisk aflejring af organiske diradikale stofferVenstre panel:Diradikalerne undersøgt i dette arbejde. Højre panel:Skitse af forskellige film (grøn farve) afsat på et underlag (grå farve). Kredit:Tuebingen Universitet Magnetisme er en egenskab
- Hvor langt kan elektrisk strøm rejse gennem en vandmasse?
- Sådan fungerer flyvekontrol
- Hvilke celler kan ses af det menneskelige øje?
- Sådan får du et kvadratrot svar fra en firkantet rod på en TI-84
- Internationale aftaler om sur regn har forbedret jordbundsforholdene i europæiske skove
- Hvad er opløseligheden af natriumnitrat i vand?


