Hvordan interagerer gasmolekyler med hinanden?
1. Svage attraktive kræfter:
* van der Waals Forces: Dette er svage, midlertidige kræfter, der opstår fra udsving i elektronfordeling omkring molekylerne. De inkluderer:
* London Dispersion Forces: Til stede i alle molekyler forekommer de på grund af midlertidige dipoler induceret i nærliggende molekyler.
* dipol-dipol-kræfter: Findes mellem polære molekyler, der har permanente dipoler, hvilket får dem til at tiltrække hinanden.
* Hydrogenbinding: En speciel type dipol-dipolinteraktion, der involverer hydrogen bundet til et stærkt elektronegativt atom som ilt, nitrogen eller fluor. Disse kræfter er især stærke.
Disse kræfter er svagere end bindingerne inden for molekyler, men de er stadig vigtige for at bestemme de fysiske egenskaber ved gasser, især ved lave temperaturer og høje tryk.
2. Frastødende kræfter:
* afvisning af kort rækkevidde: Når gasmolekyler kommer for tæt på hinanden, overlapper deres elektronskyer, hvilket forårsager en stærk frastødende kraft. Dette svarer til de frastødende kræfter mellem atomernes kerner.
3. Kollisioner:
* Elastiske kollisioner: Gasmolekyler er konstant i bevægelse og kolliderer med hinanden og væggene i deres beholder. Disse kollisioner er normalt elastisk, hvilket betyder, at kinetisk energi bevares.
4. Den ideelle gasantagelse:
* Den ideelle gaslov antager, at gasmolekyler ikke har nogen intermolekylære kræfter, og at deres kollisioner er perfekt elastiske. Selvom dette er en tilnærmelse, fungerer det godt for mange gasser ved lavt tryk og høje temperaturer.
Vigtig note: Styrken af disse interaktioner varierer markant mellem forskellige gasser. For eksempel er hydrogenbinding meget stærkere i vanddamp end i nitrogengas.
Sammendrag:
Gasmolekyler interagerer gennem svage attraktive kræfter som Van der Waals-styrker og frastødende afvisende kræfter. Disse interaktioner påvirker de fysiske egenskaber ved gasser, især ved lave temperaturer og høje tryk. Den ideelle gaslov, selv om den er en tilnærmelse, er et nyttigt værktøj til at forstå gasadfærd under mange forhold.
 Varme artikler
Varme artikler
-
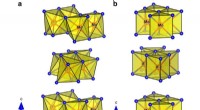 En ny metode til at udvinde brint fra vand mere effektivt for at opfange vedvarende energiKrystalstruktur og {MoTe}6 polyedre, der viser byggestenene i hver polymorf. en monoklinisk 1T′-MoTe2-fase og b hexagonal 2H-MoTe2-fase. Kredit: Naturkommunikation 10.1038/s41467-019-12831-0 En n
En ny metode til at udvinde brint fra vand mere effektivt for at opfange vedvarende energiKrystalstruktur og {MoTe}6 polyedre, der viser byggestenene i hver polymorf. en monoklinisk 1T′-MoTe2-fase og b hexagonal 2H-MoTe2-fase. Kredit: Naturkommunikation 10.1038/s41467-019-12831-0 En n -
 Ny højkapacitet natrium-ion kunne erstatte lithium i genopladelige batterierKredit:CC0 Public Domain Forskere fra University of Birmingham baner vejen for at udskifte lithium i lithium-ion-batterier med natrium, ifølge forskning offentliggjort i Journal of the American C
Ny højkapacitet natrium-ion kunne erstatte lithium i genopladelige batterierKredit:CC0 Public Domain Forskere fra University of Birmingham baner vejen for at udskifte lithium i lithium-ion-batterier med natrium, ifølge forskning offentliggjort i Journal of the American C -
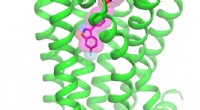 Molekylære hemmeligheder afsløret:Antipsykotikum forankret i sin receptorBredt ordineret antipsykotisk lægemiddel risperidon (lilla) er vist i interaktion med dets primære menneskelige hjernemål, D2 dopaminreceptoren (grøn). Opdagelsen af denne molekylære struktur lover
Molekylære hemmeligheder afsløret:Antipsykotikum forankret i sin receptorBredt ordineret antipsykotisk lægemiddel risperidon (lilla) er vist i interaktion med dets primære menneskelige hjernemål, D2 dopaminreceptoren (grøn). Opdagelsen af denne molekylære struktur lover -
 Escherichia coli-bakterier kaprer kobber, fodre af detEscherichia coli ( E coli ) bakterier (gule) inficerer en museblære. En immuncelle er vist med blåt. En ny undersøgelse fra Washington University School of Medicine i St. Louis viser, hvordan E. co
Escherichia coli-bakterier kaprer kobber, fodre af detEscherichia coli ( E coli ) bakterier (gule) inficerer en museblære. En immuncelle er vist med blåt. En ny undersøgelse fra Washington University School of Medicine i St. Louis viser, hvordan E. co
- Hvordan El Nino kunne påvirke sundhed, mad og økonomi
- Hvilket materiale er den bedste isolator af varme og billigt at købe?
- Stop ildebrande, før de starter - hvordan en saltopløsning giver lithiummetalbatterier sikkerhedst…
- Sådan konverteres fra gram til liter ved hjælp af tæthed
- Hvilke produkter ville du få, når du bobler klorgas gennem en natriumbromidopløsning?
- En form for rent kulstof med atomer arrangeret i form af en hul kugle?


