Hvordan effekterer temperaturnatriumphosphatopløsning pH?
Forståelse af det grundlæggende:
* natriumphosphat (Na3PO4) er et salt af en svag syre (H3PO4) og en stærk base (NaOH). Dette betyder, at dens løsninger har en tendens til at være lidt basale (pH> 7).
* PH af en opløsning er et mål for dens hydrogenion (H+) koncentration.
Temperatur og pH:
* Når temperaturen stiger, øges ioniseringen af vandet. Dette betyder, at flere H+ -ioner frigøres, hvilket fører til et lille fald i pH (dvs. gør opløsningen lidt mere sur).
* Ioniseringen af den svage syre (H3PO4) øges også med temperaturen. Dette frigiver flere H+ -ioner, hvilket yderligere bidrager til et lille fald i pH.
Nøgleovervejelser:
* Effekten af temperatur på pH er relativt lille til natriumphosphatopløsninger. Den primære faktor, der påvirker pH, er koncentrationen af opløsningen, ikke temperaturen.
* Den specifikke ændring i pH med temperatur afhænger af den indledende koncentration af natriumphosphatopløsningen og temperaturområdet. For eksempel kan en meget fortyndet løsning opleve en mere mærkbar ændring i pH end en koncentreret opløsning.
* Bufferkapacitet: Natriumphosphatopløsninger udviser en bufferkapacitet, hvilket betyder, at de modstår betydelige ændringer i pH. Dette skyldes tilstedeværelsen af både phosphation (PO43-) og dets konjugatsyre (HPO42-).
Kortfattet:
Mens temperaturen har en mindre indflydelse på pH i natriumphosphatopløsninger, er det normalt en sekundær effekt sammenlignet med koncentration. Opløsningen vil generelt blive lidt mere sur, når temperaturen øges, men opløsningens bufferkapacitet hjælper med at minimere denne ændring.
 Varme artikler
Varme artikler
-
 Undersøgelse detaljerede regulering af en multi-drug transporter(venstre mod højre):Reza Dastvan, Ph.d., Smriti Mishra, Ph.d., og Hassane Mchaourab, Ph.d., studerer den indre funktion af en proteinpumpe, der bidrager til kemoterapiresistens mod kræft. Kredit:Vande
Undersøgelse detaljerede regulering af en multi-drug transporter(venstre mod højre):Reza Dastvan, Ph.d., Smriti Mishra, Ph.d., og Hassane Mchaourab, Ph.d., studerer den indre funktion af en proteinpumpe, der bidrager til kemoterapiresistens mod kræft. Kredit:Vande -
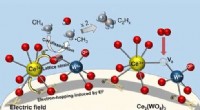 Ny, lavprisalternativ til ethylenproduktionReaktionsmekanismer for den oxidative kobling af methan (OCM) over Ce2(WO4)3-katalysatorer ved lave temperaturer i et elektrisk felt. Kredit:Waseda University Det øgede udbud og de optimerede omko
Ny, lavprisalternativ til ethylenproduktionReaktionsmekanismer for den oxidative kobling af methan (OCM) over Ce2(WO4)3-katalysatorer ved lave temperaturer i et elektrisk felt. Kredit:Waseda University Det øgede udbud og de optimerede omko -
 Intet laboratorium påkrævet:Ny teknologi kan diagnosticere infektioner på få minutterMcMaster University-forsker Richa Pandey viser ny teknologi, der kan analysere en medicinsk prøve og returnere en nøjagtig, endeligt resultat på få minutter. Kredit:McMaster University Ideen om at
Intet laboratorium påkrævet:Ny teknologi kan diagnosticere infektioner på få minutterMcMaster University-forsker Richa Pandey viser ny teknologi, der kan analysere en medicinsk prøve og returnere en nøjagtig, endeligt resultat på få minutter. Kredit:McMaster University Ideen om at -
 Et lovende gennembrud for et bedre design af elektroniske materialerKredit:Pixabay/CC0 Public Domain At finde de bedste materialer til morgendagens elektronik er målet for professor Emanuele Orgiu fra Institut national de la recherche scientifique (INRS). Blandt d
Et lovende gennembrud for et bedre design af elektroniske materialerKredit:Pixabay/CC0 Public Domain At finde de bedste materialer til morgendagens elektronik er målet for professor Emanuele Orgiu fra Institut national de la recherche scientifique (INRS). Blandt d
- Hvorfor kredser månen stadig i ekliptisk plan?
- Dyskalkuli:Sådan støtter du dit barn, hvis det har matematiske indlæringsvanskeligheder
- Undersøgelse af kigtraner afslører parrenes binding, selv før de når parringsalderen
- Hvor meget hurtigere er et nanosekund end mikrosekund?
- Accelererer kemiske reaktioner uden direkte kontakt med en katalysator
- Jordrystende videnskab i fryseren:Næste generation af vibrationssensorer ved kryogene temperaturer


